Каким цветом горит ацетилен

Ацетилен — газ с самой высокой температурой пламени!
При нормальном давлении и температуре от -82,4°С (190,6 К) до -84,0°С (189 К) ацетилен переходит в жидкое состояние, а при температуре -85°С (188 К) затвердевает, образуя кристаллы плотностью 0,76 кг/м 3 . Жидкий и твердый ацетилен легко взрывается от трения, механического или гидравлического удара и действия детонатора. Технический ацетилен при нормальных давлении и температуре представляет собой бесцветный газ с резким специфическим чесночным запахом из-за содержащихся в нем примесей в виде сернистого водорода, аммиака, фосфористого водорода и др.
В 1836 г. в Бристоле на заседании Британской ассоциации Эдмунд Дэви (Edmund Davy), профессор химии Дублинского Королевского общества и двоюродный брат Гемфри Дэви (Humphry Davy), сообщил:
. При попытке получить калий, сильно нагревая смесь прокаленного винного камня с древесным углем в большом железном сосуде, я получил черное вещество, которое легко разлагалось водой и образовывало газ, оказавшийся новым соединением углерода и водорода. Этот газ горит на воздухе ярким пламенем, более густым и светящимся даже сильнее, чем пламя маслородного газа (этилена). Если подача воздуха ограничена, горение сопровождается обильным отложением сажи. В контакте с хлором газ мгновенно взрывается, причем взрыв сопровождается большим красным пламенем и значительными отложениями сажи. Дистиллированная вода поглощает около одного объема нового газа, однако при нагревании раствора газ выделяется, по-видимому, не изменяясь. Для полного сгорания нового газа необходимо 2,5 объема кислорода. При этом образуются два объема углекислого газа и вода, которые являются единственными продуктами горения. Газ содержит столько же углерода, что и маслородный газ, но вдвое меньше водорода. Он удивительно подойдет для целей искусственного освещения, если только его удастся дешево получать.
Дэви получил карбид калия К2С2 и обработал его водой.
В статье «Карбид кальция и ацетилен — друзья не разлей вода!» мы писали о том, что его «двууглеродистый водород» впервые был назван ацетиленом французским химиком Пьером Эженом Марселеном Бертло (Marcellin Berthelot) в 1860 г. Только через 60 лет после открытия Дэви предсказанное им использование ацетилена для освещения явилось первым толчком для его промышленного получения.
Для полного сгорания 1 м 3 ацетилена по реакции: С2Н2 + 2,5O2=2СO2 + Н2O + Q1
требуется теоретически 2,5 м 3 кислорода или = 11,905 м 3 воздуха. При этом выделяется тепло Q1 ≈ 312 ккал/моль. Высшая теплотворная способность 1 м 3 ацетилена при 0°C и 760 мм рт. ст., определенная в газовом калориметре, составляет QВ = 14000 ккал/м 3 (58660 кДж/м 3 ), что соответствует расчетной:
312×1,1709×1000/26,036 = 14000 ккал/м 3
Низшая теплотворная способность при тех же условиях может быть принята QH = 13500 ккал/м 3 (55890 кДж/м 3 ).
Пpaктически при сжигании — ацетилена в горелках при восстановительном пламени в горелку подается не 2,5 м 3 кислорода на 1 м 3 ацетилена, а всего лишь от 1 до 1,2 м 3 у что примерно соответствует неполному сгоранию по реакции:
где Q2 ≈ 60 ккал/моль или 2300 ккал/кг ацетилена. Остальные 1,5-1,3 м 3 кислорода поступают в пламя из окруающего воздуха, в результате чего в наружной оболочке пламени протекает реакция:
Реакция неполного горения протекает на внешней оболочке светящегося внутреннего конуса пламени, причем под влиянием высокой температуры на внутренней поверхности конуса происходит распад ацетилена на его составляющие по реакции:
где Q4≈54 ккал/моль или 2070 ккал/кг ацетилена.
Таким образом, общая полезная теплопроизводительность пламени ацетилена применительно к сварочным процессам представляет собой сумму тепла, выделяемого при распаде ацетилена, и тепла, выделяемого при неполном сгорании, что составляет Q4 + Q2 = 2070 + 2300 = 4370 ккал/кг или 4370×1,1709 ≈ 5120 ккал/м 3 .
При содержании ацетилена в смеси около 45% (т. е. при отношении кислорода к ацетилену, примерно равном 1,25) достигается максимальная температура ацетилено-кислородного пламени, которая составляет 3200°С. Следовательно температура пламени изменяется в зависимости от состава смеси.
При содержании 27% ацетилена достигается максимальная скорость воспламенения ацетилено-кислородной смеси, которая равна 13,5 м/сек. Следовательно, в зависимости от состава смеси также изменяется и скорость воспламенения.
Данные зависимостей скорости воспламенения и температуры пламени и от содержания в ней ацетилена представлены ниже в таблице.
Содержание ацетилена в смеси в объемных процентах
Ацетилен
Бесцветный газ, слаборастворимый в воде, несколько легче атмосферного воздуха, относящийся к классу алкинов и представляющий собой ненасыщенный углерод называют ацетиленом. В его структуре все атомы имеют между собой тройную связь. Это вещество закипает при температуре — 830 °С. Формула ацетилена говорит о том, что в его состав входят только углерод и водород.
Ацетилен – это опасное вещество, которое при неаккуратном обращении с ним может взорваться. Именно поэтому для хранения этого вещества используют специально оснащенные емкости. Газ при соединении с кислородом горит, и температура может достигать 3150 °С.
Получение ацетилена
Ацетилен можно получить в лабораторных и промышленных условиях. Для получения ацетилена в лаборатории достаточно на карбид кальция (это его формула — СаС2) капнуть небольшое количество воды. после этого начинается бурная реакция выделения ацетилена. Для ее замедления допустимо использовать поваренную соль (формула NaCl).
В промышленных условиях все несколько сложнее. Для производства ацетилена применяют пиролиз метана, а так же пропана, бутана. В последнем случае формула ацетилена будет содержать большое количество примесей.
Карбидный способ производства ацетилена обеспечивает производство чистого газа. Но, такой метод получения продукта должен быть обеспечен большим количеством электроэнергии.
Пиролиз не требует большого количества электричества, все дело в том, что для производства газа, необходимо выполнить нагрев реактора и для этого используют газ, циркулирующий в первом контуре реактора. Но в потоке, который там перемещается, концентрация газа довольно мала.
Выделение ацетилена с чистой формулой во втором случае не самая простая задача и ее решение обходится довольно дорого. Существует несколько способов производства формулы ацетилена в промышленных условиях.
Электрический крекинг
Превращение метана в ацетилен происходит в электродуговой печи, при этом ее нагревают до температуры в 2000-3000 °С. При этом, напряжение на электродах достигает 1 кВ. Метан разогревают до 1600 °С. Для получения одной тонны ацетилена необходимо затратить 13 000 кВт×ч. Это существенный недостаток производства формулы ацетилена.
Технологическая схема крекинга
Пиролиз окислительный
Этот способ основан на перемешивании метана и кислорода. После производства смеси, часть ее отправляют на сжигание и полученное тепло отправляют на нагревание сырья до температуры в 16000 °С. Такой процесс отличается непрерывностью и довольно скромными затратами электрической энергии. На сегодня этот метод чаще всего можно встретить на предприятиях по производству ацетилена.
Технологическая схема процесса окислительного пиролиза
Кроме перечисленных технологий производства формулы ацетилена применяют такие как — гомогенный пиролиз, низкотемпературную плазму. Все они отличаются количеством энергетических затрат и в итоге разными хаpaктеристиками получаемого газа и его формулой.
Преимущества
Упоминание о газовой сварке моментально наводит на мысли об ацетилене. Действительно для этого процесса чаще всего применяют этот газ. Он в сочетании с кислородом обеспечивает самую высокую температуру горения пламени. Но в последние годы из-за развития различных видов сварки использование этого вида соединения металлов несколько снизилось. Более того, в некоторых отраслях произошел полный отказ от применения этих технологий. Но для выполнения определенного вида ремонтных работ она до сих пор остается незаменима.
Применение ацетилена позволяет получить следующие преимущества:
- максимальная температура пламени;
- существует возможность генерации ацетилена непосредственно на рабочем месте или приобретения его в специальных емкостях;
- довольно низкая стоимость, в сравнении с другими горючими газами.
Вместе с тем, у ацетилена есть и определенные недостатки, которые ограничивают его использование. Самый главный — это взрывоопасность. При работе с этим газом необходимо строго соблюдать меры безопасности. В частности, работы должны выполняться в хорошо проветриваемом помещении. При нарушении режимов работы возможно появление некоторых дефектов, например, пережогов.
Формула ацетилена
Строение молекулы ацетилена
Ацетилен имеет простую формулу — С2Н2. Относительно дешевый способ его получения путем перемешивания воды и карбида кальция сделал его самым применяемым газом для соединения металлов. Температура с которой горит смесь кислорода и ацетилена вынуждает выделяться твердые частицы углерода.
Ацетилен можно доставить к месту выполнения работ в специальных емкостях (газовых баллонах), а можно получить его непосредственно на рабочем месте используя для этого специально сконструированный реактор. Где происходит смешивание воды и карбида кальция.
Химические и физические свойства
Некоторые химические свойства
Свойства ацетилена во многом определены его формулой. То есть наличием атомов углерода и водорода связанных между собой.
Смешивание ацетилена с водой, при добавлении катализаторов типа солей ртути, приводит к получению уксусного альдегида. Тройная связь атомов, содержащихся в молекуле ацетилена приводит к тому, что при сгорании она выделяет 14 000 ккал/куб. м. В процессе сгорания температура поднимается до 3000 °C.
Этот газ, при соблюдении определенных условий, может превращаться в бензол. Для этого необходимо разогреть его до 4000 °С и добавить графит.
Водород, содержащийся в молекулах показывает кислотные свойства. То есть они довольно легко отрываются от молекулы в виде протонов. Ацетилен в состоянии обесцвечивает воду содержащую бром и раствор «марганцовки».
Молярная масса ацетилена составляет 26,04 г/моль. Плотность ацетилена 1,1 кг/м³.
Физические свойства
В стандартных условиях ацетилен представляет собой бесцветный газ, который пpaктически не растворяется в воде. Он начинает кипеть в -830 °С. При сжимании он начинает разлагаться с выделением большого количества энергии. Поэтому для его хранения применяют стальные баллоны способные хранить газ под высоким давлением.
Этот газ недопустимо выпускать в атмосферу. Его формула может отрицательно сказываться на окружающей среде.
Технология и режимы сварки
Ацетилено — кислородные смеси применяют для соединения деталей из углеродистых и низколегированных сталей. Например, этот метод широко применяют для создания неразъемных соединений трубопроводов. Например, труб диаметром 159 мм с толщиной стенок не более 8 мм. Но существуют и некоторые ограничения, так соединение таким методом сталей марок 12×2M1, 12×2МФСР недопустимо.
Выбор параметров режима
Для приготовления смеси необходимой для соединения металлов используют формулу 1/1,2. При обработке заготовок из легированных сталей сварщик должен отслеживать состояние пламени. В частности, нельзя допускать переизбытка ацетилена.
Расход смеси с формулой кислород/ацетилен составляет 100-130 дм 3 /час на 1 мм толщины. Мощность пламени регулируют с помощью горелки, которые подбирают в зависимости от используемого материала, его хаpaктеристик, толщины и пр
Для выполнения сварки при помощи ацетилена применяют сварочную проволоку. Ее марка должна соответствовать марке сталей свариваемых деталей. Диаметр проволоки определяют в зависимости от толщины свариваемого металла.
Для удобства технологов и непосредственно сварщиков существует множество таблиц, на основании которых можно довольно легко выбрать сварочный режим. Для этого необходимо знать следующие параметры:
- толщину стенки свариваемых заготовок;
- вид сварки — левый, правый;
На основании этого можно определить диаметр присадочной проволоки и подобрать расход ацетилена. К примеру, толщина составляет 5-6 мм, для выполнения работ будет использован наконечник № 4. То есть на основании табличных данных диаметр проволоки будет составлять для левой сварки 3,5 мм, для правой 3. Расход ацетилена в таком случае будет составлять при левом способе 60 -780 дм 3 /час, при правом 650-750 дм 3 /час.
Сварку выполняют небольшими участками по 10-15 мм. Работа производится в следующей последовательности. На первом этапе выполняют оплавление кромок. После этого выполняют наложение корня шва. По окончании формирования корня, можно продолжать сварку далее. Если толщина заготовок составляет 4 мм то сварку допустимо выполнять в один слой. Если толщина превышает указанную, то необходимо наложить второй. Его укладывают только после того, как выполнен корень шва по всей заданной длине.
Для улучшения качества сварки допускается выполнение предварительного нагрева. То есть будущий сварной стык прогревают с помощью горелки. Если принят за основу такой способ, то прогрев надо выполнять после каждой остановки заново.
Выполнение швов газом может выполняться в любом прострaнcтвенном положении. Например, при выполнении вертикального шва существуют свои особенности. Так, вертикальный шов должен исполняться снизу вверх.
При выполнении сварочных работ перерывы в работе недопустимы, по крайней мере до окончания всей разделки шва. При остановке в работе горелку необходимо отводить медленно, в противном случае, могут возникнуть дефекты шва — paковины и поры. Интересная особенность существует при сварке трубопроводов, в ней не допустим сквозняк и поэтому концы труб необходимо заглушать.
Читать еще: Циклонный фильтр принцип работыВиды ацетилена
Промышленность выпускает два вида ацетилена — твердый и в виде газа.
Газообразный
Ацетилен обладает резким запахом и это дает определённые преимущества при его утечке. По своей массе он близок к атмосферному воздуху.
Жидкий
Жидкий ацетилен не обладает ни каким цветом. У него есть одна особенность он преломляет цвет. Ацетилен и жидкий, и газообразный, представляет собой опасное вещество. То есть при нарушении правил обращения с ним взрыв может произойти в любую секунду, даже при комнатной температуре. Для повышения безопасности при обращении с ним, применяют так называемую флегматизацией. То есть в ёмкости, предназначенной для хранения ацетилена размещают пористое вещество. Которое снижает его опасность
Реакции ацетилена
Ацетилен вступает в реакцию с различными соединениями, например, солями меди и серебра. В результате таких взаимодействий получают вещества под названием ацетилениды. Их отличительная черта — взрывоопасность.
Использование ацетилена
Кроме сварки ацетилен применяют в следующих случаях:
- для получения яркого света в автономных источниках света (карбидная лампа);
- при изготовлении взрывчатых веществ, это уже упоминавшиеся ацетилениды;
- получения некоторых химических веществ, например, уксуса, спирта, полимеров и пр;
- кроме этого, ацетилен нашел свое применение и в paкетной технике, в качестве компонента топлива.
Стандарты
Производители ацетилена руководствуются при его получении требованиями ГОСТ 5457-75. В нем определены требования к газообразному и жидкому ацетилену.
Скачать ГОСТ 5457-75
Газ в баллоне
Для хранения и трaнcпортировки ацетилена применяют газовые баллоны. Для изготовления этого устройства применяют бесшовную трубу, которую производят на основании ГОСТ 949-73. В нижней части корпуса устанавливают специальную опору, которая позволяет его устанавливать в вертикальное положение. В верхней части баллона устанавливают вентиль, через который выполняют заправку/отдачу газа. Эти вентили выпускают под маркой ВБА-1 или BA-I. Их применение допустимо только на баллонах предназначенном для хранения этого газа.
Ацетилен в баллонах
На поверхности баллона должны быть выбиты следующие данные:
Товарный знак производителя, дата производства, параметры давления и некоторые другие, которые хаpaктеризуют это изделие.
На поверхность баллонов наносят краску белого цвета. Кроме этого, в обязательном порядке должны быть нанесена надпись АЦЕТИЛЕН. При этом высота шрифта не должна быть менее 6 см.
Баллон заполняют пористым наполнителем. Его задача более равномерное распределение газа внутри баллон, другая задача заключается в пpeдoxpaнении газа от распада.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Каким цветом горит ацетилен
Потому что кислорода содержащегося в воздухе не хватает для полного сгорания ацетилена, не окисленный углерод выделяется в виде сажи, которая, по сути, и является копотью. В кислородной среде ацетилен сгорает полностью и не коптит, что можно наблюдать при резке металла ацетиленовым резаком.
В составе ацетилена большая массовая доля углерода. Он не успевает сгорать и выделяется в виде сажи, отчего коптит очень сильно. Причем смесь с кислородом может быть и взрывчатой при больших концентрациях, а также пламя очень яркое. Можно наблюдать такое явление, как горение снега. В итоге от горения ацетилена много копоти и сажи.
Ацетилен
Ацетилен – бесцветный горючий газ C2H2 с атомной массой 26,04, немного легче воздуха. Обладает резким запахом.
В промышленности ацетилен обычно получают из карбида кальция (CaC2) при разложении последнего водой.
Ацетилен самовоспламеняется при температуре 335°С, смесь ацетилена с кислородом воспламеняется при температуре 297–306°С, смесь ацетилена с воздухом – при температуре 305–470°С.
Ацетилен взрывоопасен при следующих условиях:
- при увеличении температуры более 450–500°С и давления более 1,5–2 ат (около 150–200 кПа);
- при атмосферном давлении ацетилено-кислородная смесь с содержанием ацетилена от 2,3 до 93% взрывается от искры, пламени, сильного местного нагрева и др.;
- при аналогичных условиях смесь ацетилена с воздухом взрывается при содержании в ней ацетилена от 2,2 до 80,7%;
- в результате длительного соприкосновении ацетилена с серебром или медью образуется взрывчатое ацетиленистое серебро или медь, взрывающиеся при повышении температуры или ударе.
Взрыв ацетилена способен вызвать значительные разрушения и тяжелые несчастные случаи: при взрыве 1 кг ацетилена выделяется примерно в два раза больше тепла, чем при взрыве 1 кг тротила и примерно в 1,5 раза больше, чем при взрыве 1 кг нитроглицерина.
Меры безопасности при работе с ацетиленом
- содержание ацетилена в воздухе рабочей зоны необходимо непрерывно контролировать автоматическими приборами, сигнализирующими о превышении допустимой взрывобезопасной концентрации ацетилена в воздухе, равной 0,46%;
- при работе с ацетиленовыми баллонами поблизости не должно быть открытого пламени или отопительной системы; запрещается работать с баллонами, находящимися в горизонтальном положении, с незакрепленными баллонами, с неисправными баллонами; необходимо использовать неискрящийся инструмент, освещение и электрическое оборудование только во взрывобезопасном исполнении;
- в случае обнаружения утечки ацетилена из баллона (по запаху и звуку) необходимо по возможности быстро закрыть вентиль баллона специальным неискрящимся ключом;
- при нагреве баллон с ацетиленом может взорваться с крайне разрушительными последствиями; в случае пожара необходимо по возможности удалить из опасной зоны холодные баллоны с ацетиленом, оставшиеся баллоны постоянно охлаждать водой или специальными составами до полного остывания; при загорании ацетилена, выходящего из баллона, необходимо по возможности быстро закрыть вентиль баллона специальным неискрящимся ключом и поливать баллон водой до полного остывания; при сильном возгорании пожаротушение необходимо производить с безопасного расстояния; при пожаротушении рекомендуется применять огнетушители с содержанием флегматизирующей концентрации азота 70% по объему, диоксида углерода 57% по объему, водяные струи, песок, сжатый азот, асбестовое полотно, токораспыленную пену и воду; при тушении сильного пожара используются огнезащитные костюмы, противогазы и т.п.
Применение ацетилена при сварке
Ацетилен – основной горючий газ, используемый при газовой сварке, а также широко применяется для газовой резки (кислородной резки). Температура ацетилено-кислородного пламени может достигать 3300°C. Благодаря этому ацетилен по сравнению с более доступными горючими газами (пропан-бутаном, природным газом и др.) обеспечивает более высокое качество и производительность сварки.
Снабжение постов ацетиленом для газовой сварки и резки может осуществляться
- от баллонов с ацетиленом и
- от ацетиленового генератора.
Для хранения ацетилена обычно используются стандартные баллоны емкостью 40 л, окрашенные в белый цвет, с надписью «Ацетилен» красного цвета (ПБ 10-115-96, ГОСТ 949-73). Согласно ГОСТ 5457-75 для газопламенной обработки металлов применяется технический ацетилен растворенный марки Б и газообразный.
Таблица. Хаpaктеристики марок технического ацетилена (ГОСТ 5457-75), используемого при сварке и резке.
Баллоны заполнены пористой массой, пропитанной ацетоном. Ацетилен хорошо растворяется а ацетоне: при нормальной температуре и давлении в 1 л ацетона растворяется 23 л ацетилена (в 1 л бензина растворяется 5,7 л ацетилена, в 1 л воды – 1,15 л ацетилена). Пористая масса выполняет следующие функции:
- повышает безопасность при работе с баллоном – за счет пористой массы общий объем ацетилена разделен на отдельные ячейки; таким образом, вероятность распространения общего фронта горения и взрыва значительно уменьшается;
- позволяет повысить количество ацетилена в баллоне, ускорить процесс его растворения при заполнении баллона и выделении при отборе газа – поскольку при использовании пористой массы, пропитанной ацетоном, обеспечивается большая поверхность взаимного контакта между газом и ацетоном.
В качестве пористых масс могут применяться активированный уголь, пемза, волокнистый асбест.
Таблица. Допустимое давление газа в баллоне в зависимости от температуры (при номинальном давлении 1,9 МПа / +20°С) (ГОСТ 5457-75)
Таблица. Остаточное давление газа в баллоне, поступающем от потребителя (ГОСТ 5457-75)
40-литровые баллоны с максимальным давлением газа 1,9 МПа при температуре 20°С обычно заполняют 5–5,8 кг ацетилена (4,6–5,3 м 3 газа при температуре 20°С и давлении 760 мм рт. ст.). Масса ацетилена в баллоне определяется по разности масс баллона до и после наполнения газом. Объем ацетилена равен отношению его массы и плотности. Так, объем 5,5 кг ацетилена при температуре 20°С и давлении 760 мм рт. ст. составляет 5,5/1,09 = 5,05 м 3 .
Таблица. Сравнительные хаpaктеристики ацетилена, пропана и метилацетилен-алленовой фpaкции (МАФ)
При нормальном давлении и температуре от -82,4°С (190,6 К) до -84,0°С (189 К) ацетилен переходит в жидкое состояние, а при температуре -85°С (188 К) затвердевает, образуя кристаллы плотностью 0,76 кг/м 3 . Жидкий и твердый ацетилен легко взрывается от трения, механического или гидравлического удара и действия детонатора. Технический ацетилен при нормальных давлении и температуре представляет собой бесцветный газ с резким специфическим чесночным запахом из-за содержащихся в нем примесей в виде сернистого водорода, аммиака, фосфористого водорода и др.
В 1836 г. в Бристоле на заседании Британской ассоциации Эдмунд Дэви (Edmund Davy), профессор химии Дублинского Королевского общества и двоюродный брат Гемфри Дэви (Humphry Davy), сообщил:
. При попытке получить калий, сильно нагревая смесь прокаленного винного камня с древесным углем в большом железном сосуде, я получил черное вещество, которое легко разлагалось водой и образовывало газ, оказавшийся новым соединением углерода и водорода. Этот газ горит на воздухе ярким пламенем, более густым и светящимся даже сильнее, чем пламя маслородного газа (этилена). Если подача воздуха ограничена, горение сопровождается обильным отложением сажи. В контакте с хлором газ мгновенно взрывается, причем взрыв сопровождается большим красным пламенем и значительными отложениями сажи. Дистиллированная вода поглощает около одного объема нового газа, однако при нагревании раствора газ выделяется, по-видимому, не изменяясь. Для полного сгорания нового газа необходимо 2,5 объема кислорода. При этом образуются два объема углекислого газа и вода, которые являются единственными продуктами горения. Газ содержит столько же углерода, что и маслородный газ, но вдвое меньше водорода. Он удивительно подойдет для целей искусственного освещения, если только его удастся дешево получать.
Дэви получил карбид калия К2С2 и обработал его водой.
В статье «Карбид кальция и ацетилен — друзья не разлей вода!» мы писали о том, что его «двууглеродистый водород» впервые был назван ацетиленом французским химиком Пьером Эженом Марселеном Бертло (Marcellin Berthelot) в 1860 г. Только через 60 лет после открытия Дэви предсказанное им использование ацетилена для освещения явилось первым толчком для его промышленного получения.
Для полного сгорания 1 м 3 ацетилена по реакции: С2Н2 + 2,5O2=2СO2 + Н2O + Q1
требуется теоретически 2,5 м 3 кислорода или = 11,905 м 3 воздуха. При этом выделяется тепло Q1 ≈ 312 ккал/моль. Высшая теплотворная способность 1 м 3 ацетилена при 0°C и 760 мм рт. ст., определенная в газовом калориметре, составляет QВ = 14000 ккал/м 3 (58660 кДж/м 3 ), что соответствует расчетной:
312×1,1709×1000/26,036 = 14000 ккал/м 3
Низшая теплотворная способность при тех же условиях может быть принята QH = 13500 ккал/м 3 (55890 кДж/м 3 ).
Пpaктически при сжигании — ацетилена в горелках при восстановительном пламени в горелку подается не 2,5 м 3 кислорода на 1 м 3 ацетилена, а всего лишь от 1 до 1,2 м 3 у что примерно соответствует неполному сгоранию по реакции:
где Q2 ≈ 60 ккал/моль или 2300 ккал/кг ацетилена. Остальные 1,5-1,3 м 3 кислорода поступают в пламя из окруающего воздуха, в результате чего в наружной оболочке пламени протекает реакция:
Реакция неполного горения протекает на внешней оболочке светящегося внутреннего конуса пламени, причем под влиянием высокой температуры на внутренней поверхности конуса происходит распад ацетилена на его составляющие по реакции:
где Q4≈54 ккал/моль или 2070 ккал/кг ацетилена.
Таким образом, общая полезная теплопроизводительность пламени ацетилена применительно к сварочным процессам представляет собой сумму тепла, выделяемого при распаде ацетилена, и тепла, выделяемого при неполном сгорании, что составляет Q4 + Q2 = 2070 + 2300 = 4370 ккал/кг или 4370×1,1709 ≈ 5120 ккал/м 3 .
При содержании ацетилена в смеси около 45% (т. е. при отношении кислорода к ацетилену, примерно равном 1,25) достигается максимальная температура ацетилено-кислородного пламени, которая составляет 3200°С. Следовательно температура пламени изменяется в зависимости от состава смеси.
При содержании 27% ацетилена достигается максимальная скорость воспламенения ацетилено-кислородной смеси, которая равна 13,5 м/сек. Следовательно, в зависимости от состава смеси также изменяется и скорость воспламенения.
Данные зависимостей скорости воспламенения и температуры пламени и от содержания в ней ацетилена представлены ниже в таблице.
Содержание ацетилена в смеси в объемных процентах
Ацетилен
Общие сведения
Ацетилен — ненасыщенный углеводород C 2 H 2 . Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. В природе на Земле пpaктически не встречается, т.к. из-за присутствия кислорода это крайне неустойчивое соединение, получается путем синтеза. Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Впервые газообразный ацетилен получил в 1836 г. Эдмунд Дэви при разложении водой карбида калия, полученного при сплавлении металлического калия с углем: К 2 С 2 + 2Н 2 О = С 2 Н 2 + 2КОН.
С конца 19 в., когда был разработан дешевый способ получения ацетилена из карбида кальция (CaC 2 + 2H 2 O = C 2 H 2 + Ca(OH) 2 , который в свою очередь получали прокаливанием смеси угля и негашеной извести (СаО + 3С = СаС 2 + СО), этот газ стали использовать для освещения. В пламени при высокой температуре ацетилен, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому). Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
Физические свойства
При нормальных условиях — бесцветный газ, запах которого напоминает запах чеснока, малорастворим в воде, легче воздуха. Чистый ацетилен при охлаждении сжижается при -83,8°С, а при дальнейшем понижении температуры быстро затвердевает. Он умеренно растворим в воде (1150 мл в 1 л воды при 15°С и атмосферном давлении) и хорошо в органических растворителях, особенно в ацетоне (25 л в 1 л ацетона при тех же условиях и 300 л под давлением 12 атм). Термодинамически ацетилен неустойчив: он взрывается при нагревании до 500° С, а при обычной температуре — при повышении давления до 2 атм. Поэтому его хранят в баллонах, наполненных пористым инертным материалом, который пропитан ацетоном.
Химические свойства
Для ацетилена (этина) хаpaктерны реакции присоединения, димеризации, полимеризации, цикломеризации.
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м3. При сгорании температура пламени достигает 3300°С (5972 °F). Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди. Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Способ производства
В промышленности ацетилен часто получают действием воды на карбид кальция , а также при дегидрировании двух молекул метана при температуре свыше 1400°C.
Применение
Ацетилен используют для так называемой автогенной сварки и резки металлов. Для этого нужны два баллона с газами — с кислородом и с ацетиленом. Газы из баллонов поступают в специальную горелку. При сгорании ацетилена в кислороде получается очень горячее пламя; максимальная его температура (3200° С) достигается при содержании ацетилена 45% по объему. В таком пламени очень быстро расплавляются даже толстые куски стали.
Как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (карбидка).
Ацетилен может служить исходным продуктом для синтеза многих более сложных органических соединений. Эта область применения ацетилена в настоящее время является самой обширной. Ацетилен — реакционноспособное соединение, вступающее в многочисленные реакции. Химия ацетилена богата. Из него можно получить сотни разнообразных соединений.
Он используется в производстве взрывчатых веществ (ацетилениды), для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
Преимущества ацетилена при газопламенной обработке металлов
Применение ацетилена для газопламенной обработки металлов испытывает сильную конкуренцию со стороны более доступных горючих газов (природный газ, пропан–бутан и тд.). Однако, преимущество ацетилена – в самой высокой температуре горения, которая достигает 3200 ° С. Именно поэтому газопламенная обработка ответственных узлов машиностроительных конструкций производится только с помощью ацетилена, который обеспечивает наивысшую производительность и качество процесса сварки.
Ацетилен — свойства и хаpaктеристики
Ацетилен – бесцветный горючий газ C2H2 с атомной массой 26,04, немного легче воздуха. Обладает резким запахом.
В промышленности ацетилен обычно получают из карбида кальция (CaC2) при разложении последнего водой.
Ацетилен самовоспламеняется при температуре 335°С, смесь ацетилена с кислородом воспламеняется при температуре 297–306°С, смесь ацетилена с воздухом – при температуре 305–470°С.
Ацетилен взрывоопасен при следующих условиях:
при увеличении температуры более 450–500°С и давления более 1,5–2 ат (около 150–200 кПа);
при атмосферном давлении ацетилено-кислородная смесь с содержанием ацетилена от 2,3 до 93% взрывается от искры, пламени, сильного местного нагрева и др.;
при аналогичных условиях смесь ацетилена с воздухом взрывается при содержании в ней ацетилена от 2,2 до 80,7%;
в результате длительного соприкосновении ацетилена с серебром или медью образуется взрывчатое ацетиленистое серебро или медь, взрывающиеся при повышении температуры или ударе.
Взрыв ацетилена способен вызвать значительные разрушения и тяжелые несчастные случаи: при взрыве 1 кг ацетилена выделяется примерно в два раза больше тепла, чем при взрыве 1 кг тротила и примерно в 1,5 раза больше, чем при взрыве 1 кг нитроглицерина.
Меры безопасности при работе с ацетиленом
содержание ацетилена в воздухе рабочей зоны необходимо непрерывно контролировать автоматическими приборами, сигнализирующими о превышении допустимой взрывобезопасной концентрации ацетилена в воздухе, равной 0,46%;
при работе с ацетиленовыми баллонами поблизости не должно быть открытого пламени или отопительной системы; запрещается работать с баллонами, находящимися в горизонтальном положении, с незакрепленными баллонами, с неисправными баллонами; необходимо использовать неискрящийся инструмент, освещение и электрическое оборудование только во взрывобезопасном исполнении;
в случае обнаружения утечки ацетилена из баллона (по запаху и звуку) необходимо по возможности быстро закрыть вентиль баллона специальным неискрящимся ключом;
при нагреве баллон с ацетиленом может взорваться с крайне разрушительными последствиями; в случае пожара необходимо по возможности удалить из опасной зоны холодные баллоны с ацетиленом, оставшиеся баллоны постоянно охлаждать водой или специальными составами до полного остывания; при загорании ацетилена, выходящего из баллона, необходимо по возможности быстро закрыть вентиль баллона специальным неискрящимся ключом и поливать баллон водой до полного остывания; при сильном возгорании пожаротушение необходимо производить с безопасного расстояния; при пожаротушении рекомендуется применять огнетушители с содержанием флегматизирующей концентрации азота 70% по объему, диоксида углерода 57% по объему, водяные струи, песок, сжатый азот, асбестовое полотно, токораспыленную пену и воду; при тушении сильного пожара используются огнезащитные костюмы, противогазы и т.п.
Применение ацетилена при сварке
Ацетилен – основной горючий газ, используемый при газовой сварке, а также широко применяется для газовой резки (кислородной резки). Температура ацетилено-кислородного пламени может достигать 3300°C. Благодаря этому ацетилен по сравнению с более доступными горючими газами (пропан-бутаном, природным газом и др.) обеспечивает более высокое качество и производительность сварки.
Снабжение постов ацетиленом для газовой сварки и резки может осуществляться
от баллонов с ацетиленом и
от ацетиленового генератора.
Для хранения ацетилена обычно используются стандартные баллоны емкостью 40 л, окрашенные в белый цвет, с надписью «Ацетилен» красного цвета (ПБ 10-115-96, ГОСТ 949-73). Согласно ГОСТ 5457-75 для газопламенной обработки металлов применяется технический ацетилен растворенный марки Б и газообразный.
Таблица. Хаpaктеристики марок технического ацетилена (ГОСТ 5457-75), используемого при сварке и резке.
Параметр Ацетилен технический
растворенный марки Б газообразный
первого сорта второго сорта
Объемная доля ацетилена C2H2, %, не менее 99,1 98,8 98,5
Объемная доля воздуха и других газов, малорастворимых в воде, %, не более 0,8 1,0 1,4
Объемная доля фосфористого водорода PH3, %, не более 0,02 0,05 0,08
Объемная доля сероводорода H2S, %, не более 0,005 0,05 0,05
Массовая концентрация водяных паров при давлении 101,3 кПа (760 мм рт. ст.) и температуре 20°С, г/м3, не более 0,5 0,6 не нормируется
что соответствует температуре насыщения, не выше (°C) -24 -22
Баллоны заполнены пористой массой, пропитанной ацетоном. Ацетилен хорошо растворяется а ацетоне: при нормальной температуре и давлении в 1 л ацетона растворяется 23 л ацетилена (в 1 л бензина растворяется 5,7 л ацетилена, в 1 л воды – 1,15 л ацетилена). Пористая масса выполняет следующие функции:
повышает безопасность при работе с баллоном – за счет пористой массы общий объем ацетилена разделен на отдельные ячейки; таким образом, вероятность распространения общего фронта горения и взрыва значительно уменьшается;
позволяет повысить количество ацетилена в баллоне, ускорить процесс его растворения при заполнении баллона и выделении при отборе газа – поскольку при использовании пористой массы, пропитанной ацетоном, обеспечивается большая поверхность взаимного контакта между газом и ацетоном.
В качестве пористых масс могут применяться активированный уголь, пемза, волокнистый асбест.
Таблица. Допустимое давление газа в баллоне в зависимости от температуры (при номинальном давлении 1,9 МПа / +20°С) (ГОСТ 5457-75)
Температура, °С -5 0 +5 +10 +15 +20 +25 +30 +35 +40
Давление в
баллоне,
не более МПа 1,34 1,4 1,5 1,65 1,8 1,9 2,15 2,35 2,6 3
кгс/см2 13,4 14 15 16,5 18 19 21,5 23,5 26 30
Таблица. Остаточное давление газа в баллоне, поступающем от потребителя (ГОСТ 5457-75)
Температура, °С до 0 от 0 до +15 от +15 до +25 от +25 до +35
Остаточное
давление в баллоне,
не менее МПа 0,05 0,1 0,2 0,3
кгс/см2 0,5 1 2 3
40-литровые баллоны с максимальным давлением газа 1,9 МПа при температуре 20°С обычно заполняют 5–5,8 кг ацетилена (4,6–5,3 м3 газа при температуре 20°С и давлении 760 мм рт. ст.). Масса ацетилена в баллоне определяется по разности масс баллона до и после наполнения газом. Объем ацетилена равен отношению его массы и плотности. Так, объем 5,5 кг ацетилена при температуре 20°С и давлении 760 мм рт. ст. составляет 5,5/1,09 = 5,05 м3.
Таблица. Сравнительные хаpaктеристики ацетилена, пропана и метилацетилен-алленовой фpaкции (МАФ)
Параметр ацетилен пропан МАФ
Чувствительность к удару, безопасность нестабилен стабилен стабилен
Токсичность незначительная
Предел взрываемости в воздухе (%) 2,2–81 2,0–9,5 3,4–10,8
Предел взрываемости в кислороде (%) 2,3–93 2,4–57 2,5–60
Температура пламени (°С) 3087 2526 2927 *
Реакции с обычными металлами избегать сплавов, содержащих более 70% меди незначительные ограничения избегать сплавов, содержащих более 65–67% меди
Склонность к обратному удару значительная незначительная незначительная
Скорость сгорания в кислороде (м/с) 6,10 3,72 4,70
Плотность газа (кг/м3) 1,17 (при 0°С)
1,09 (при 20°С) 2,02 (при 0°С) 1,70 (при 0°С) *
Плотность в жидком состоянии при 15,6°С (кг/м3) – 513 575
Отношение расхода кислорода к горючему газу (м3/м3) при нормальном пламени 1–1,2 3,50 2,3–2,5
Химия пламени
Чем проклинать тьму,
лучше зажечь хотя бы
одну маленькую свечу.
Конфуций
В начале
Первые попытки понять механизм горения связаны с именами англичанина Роберта Бойля, француза Антуана Лорана Лавуазье и русского Михаила Васильевича Ломоносова. Оказалось, что при горении вещество никуда не «исчезает», как наивно полагали когда-то, а превращается в другие вещества, в основном газообразные и потому невидимые. Лавуазье в 1774 году впервые показал, что при горении из воздуха уходит примерно пятая его часть. В течение XIX века ученые подробно исследовали физические и химические процессы, сопровождающие горение. Необходимость таких работ была вызвана прежде всего пожарами и взрывами в шахтах.
Но только в последней четверти ХХ века были выявлены основные химические реакции, сопровождающие горение, и по сей день в химии пламени осталось немало темных пятен. Их исследуют самыми современными методами во многих лабораториях. У этих исследований несколько целей. С одной стороны, надо оптимизировать процессы горения в топках ТЭЦ и в цилиндрах двигателей внутреннего сгорания, предотвратить взрывное горение (детонацию) при сжатии в цилиндре автомобиля воздушно-бензиновой смеси. С другой стороны, необходимо уменьшить количество вредных веществ, образующихся в процессе горения, и одновременно — искать более эффективные средства тушения огня.
Существуют два вида пламени. Топливо и окислитель (чаще всего кислород) могут принудительно или самопроизвольно подводиться к зоне горения порознь и смешиваться уже в пламени. А могут смешиваться заранее — такие смеси способны гореть или даже взрываться в отсутствие воздуха, как, например, пороха, пиротехнические смеси для фейерверков, paкетные топлива. Горение может происходить как с участием кислорода, поступающего в зону горения с воздухом, так и при помощи кислорода, заключенного в веществе-окислителе. Одно из таких веществ — бертолетова соль (хлорат калия KClO3); это вещество легко отдает кислород. Сильный окислитель — азотная кислота HNO3: в чистом виде она воспламеняет многие органические вещества. Нитраты, соли азотной кислоты (например, в виде удобрения — калийной или аммиачной селитры), легко воспламеняются, если смешаны с горючими веществами. Еще один мощный окислитель, тетраоксид азота N2O4 — компонент paкетных топлив. Кислород могут заменить и такие сильные окислители, как, например, хлор, в котором горят многие вещества, или фтор. Чистый фтор — один из самых сильных окислителей, в его струе горит вода.
Цепные реакции
Основы теории горения и распространения пламени были заложены в конце 20-х годов прошлого столетия. В результате этих исследований были открыты разветвленные цепные реакции. За это открытие отечественный физикохимик Николай Николаевич Семенов и английский исследователь Сирил Хиншельвуд были в 1956 году удостоены Нобелевской премии по химии. Более простые неразветвленные цепные реакции открыл еще в 1913 году немецкий химик Макс Боденштейн на примере реакции водорода с хлором. Суммарно реакция выражается простым уравнением H2 + Cl2 = 2HCl. На самом деле она идет с участием очень активных осколков молекул — так называемых свободных радикалов. Под действием света в ультрафиолетовой и синей областях спектра или при высокой температуре молекулы хлора распадаются на атомы, которые и начинают длинную (иногда до миллиона звеньев) цепочку превращений; каждое из этих превращений называется элементарной реакцией:
Cl + H2 → HCl + H,
H + Cl2 → HCl + Cl и т. д.
На каждой стадии (звене реакции) происходит исчезновение одного активного центра (атома водорода или хлора) и одновременно появляется новый активный центр, продолжающий цепь. Цепи обрываются, когда встречаются две активные частицы, например Cl + Cl → Cl2. Каждая цепь распространяется очень быстро, поэтому, если генерировать «первоначальные» активные частицы с высокой скоростью, реакция пойдет так быстро, что может привести к взрыву.
Н. Н. Семенов и Хиншельвуд обнаружили, что реакции горения паров фосфора и водорода идут иначе: малейшая искра или открытое пламя могут вызвать взрыв даже при комнатной температуре. Эти реакции — разветвленно-цепные: активные частицы в ходе реакции «размножаются», то есть при исчезновении одной активной частицы появляются две или три. Например, в смеси водорода и кислорода, которая может спокойно храниться сотни лет, если нет внешних воздействий, появление по той или иной причине активных атомов водорода запускает такой процесс:
Таким образом, за ничтожный промежуток времени одна активная частица (атом H) превращается в три (атом водорода и два гидроксильных радикала OH), которые запускают уже три цепи вместо одной. В результате число цепей лавинообразно растет, что моментально приводит к взрыву смеси водорода и кислорода, поскольку в этой реакции выделяется много тепловой энергии. Атомы кислорода присутствуют в пламени и при горении других веществ. Их можно обнаружить, если направить струю сжатого воздуха поперек верхней части пламени горелки. При этом в воздухе обнаружится хаpaктерный запах озона — это атомы кислорода «прилипли» к молекулам кислорода с образованием молекул озона: О + О2 = О3, которые и были вынесены из пламени холодным воздухом.
Возможность взрыва смеси кислорода (или воздуха) со многими горючими газами — водородом, угарным газом, метаном, ацетиленом — зависит от условий, в основном от температуры, состава и давления смеси. Так, если в результате утечки бытового газа на кухне (он состоит в основном из метана) его содержание в воздухе превысит 5%, то смесь взорвется от пламени спички или зажигалки и даже от маленькой искры, проскочившей в выключателе при зажигании света. Взрыва не будет, если цепи обрываются быстрее, чем успевают разветвляться. Именно поэтому была безопасной лампа для шахтеров, которую английский химик Хэмфри Дэви разработал в 1816 году, ничего не зная о химии пламени. В этой лампе открытый огонь был отгорожен от внешней атмосферы (которая могла оказаться взрывоопасной) частой металлической сеткой. На поверхности металла активные частицы эффективно исчезают, превращаясь в стабильные молекулы, и потому не могут проникнуть во внешнюю среду.
Полный механизм разветвленно-цепных реакций очень сложен и может включать более сотни элементарных реакций. К разветвленно-цепным относятся многие реакции окисления и горения неорганических и органических соединений. Таковой же будет и реакция деления ядер тяжелых элементов, например плутония или урана, под воздействием нейтронов, которые выступают аналогами активных частиц в химических реакциях. Проникая в ядро тяжелого элемента, нейтроны вызывают его деление, что сопровождается выделением очень большой энергии; одновременно из ядра вылетают новые нейтроны, которые вызывают деление соседних ядер. Химические и ядерные разветвленно-цепные процессы описываются сходными математическими моделями.
Что надо для начала
Чтобы началось горение, нужно выполнить ряд условий. Прежде всего, температура горючего вещества должна превышать некое предельное значение, которое называется температурой воспламенения. Знаменитый роман Рэя Брэдбери «451 градус по Фаренгeйту» назван так потому, что примерно при этой температуре (233°C) загорается бумага. Это «температура воспламенения», выше которой твердое топливо выделяет горючие пары или газообразные продукты разложения в количестве, достаточном для их устойчивого горения. Примерно такая же температура воспламенения и у сухой сосновой древесины.
Температура пламени зависит от природы горючего вещества и от условий горения. Так, температура в пламени метана на воздухе достигает 1900°C, а при горении в кислороде — 2700°C. Еще более горячее пламя дают при сгорании в чистом кислороде водород (2800°C) и ацетилен (3000°C). Недаром пламя ацетиленовой горелки легко режет почти любой металл. Самую же высокую температуру, около 5000°C (она зафиксирована в Книге рекордов Гиннесса), дает при сгорании в кислороде легкокипящая жидкость — субнитрид углерода С4N2 (это вещество имеет строение дицианоацетилена NC–C=C–CN). А по некоторым сведениям, при горении его в атмосфере озона температура может доходить до 5700°C. Если же эту жидкость поджечь на воздухе, она сгорит красным коптящим пламенем с зелено-фиолетовой каймой. С другой стороны, известны и холодные пламена. Так, например, горят при низких давлениях пары фосфора. Сравнительно холодное пламя получается и при окислении в определенных условиях сероуглерода и легких углеводородов; например, пропан дает холодное пламя при пониженном давлении и температуре от 260–320°C.
Только в последней четверти ХХ века стал проясняться механизм процессов, происходящих в пламени многих горючих веществ. Механизм этот очень сложен. Исходные молекулы обычно слишком велики, чтобы, реагируя с кислородом, непосредственно превратиться в продукты реакции. Так, например, горение октана, одного из компонентов бензина, выражается уравнением 2С8Н18 + 25О2 = 16СО2 + 18Н2О. Однако все 8 атомов углерода и 18 атомов водорода в молекуле октана никак не могут одновременно соединиться с 50 атомами кислорода: для этого должно разорваться множество химических связей и образоваться множество новых. Реакция горения происходит многостадийно — так, чтобы на каждой стадии разрывалось и образовывалось лишь небольшое число химических связей, и процесс состоит из множества последовательно протекающих элементарных реакций, совокупность которых и представляется наблюдателю как пламя. Изучать элементарные реакции сложно прежде всего потому, что концентрации реакционно-способных промежуточных частиц в пламени крайне малы.
Внутри пламени
Оптическое зондирование разных участков пламени с помощью лазеров позволило установить качественный и количественный состав присутствующих там активных частиц — осколков молекул горючего вещества. Оказалось, что даже в простой с виду реакции горения водорода в кислороде 2Н2 + О2 = 2Н2О происходит более 20 элементарных реакций с участием молекул О2, Н2, О3, Н2О2, Н2О, активных частиц Н, О, ОН, НО2. Вот, например, что написал об этой реакции английский химик Кеннет Бэйли в 1937 году: «Уравнение реакции соединения водорода с кислородом — первое уравнение, с которым знакомится большинство начинающих изучать химию. Реакция эта кажется им очень простой. Но даже профессиональные химики бывают несколько поражены, увидев книгу в сотню страниц под названием «Реакция кислорода с водородом», опубликованную Хиншельвудом и Уильямсоном в 1934 году». К этому можно добавить, что в 1948 году была опубликована значительно большая по объему монография А. Б. Налбандяна и В. В. Воеводского под названием «Механизм окисления и горения водорода».
Современные методы исследования позволили изучить отдельные стадии подобных процессов, измерить скорость, с которой различные активные частицы реагируют друг с другом и со стабильными молекулами при разных температурах. Зная механизм отдельных стадий процесса, можно «собрать» и весь процесс, то есть смоделировать пламя. Сложность такого моделирования заключается не только в изучении всего комплекса элементарных химических реакций, но и в необходимости учитывать процессы диффузии частиц, теплопереноса и конвекционных потоков в пламени (именно последние устраивают завораживающую игру языков горящего костра).
Откуда все берется
Основное топливо современной промышленности — углеводороды, начиная от простейшего, метана, и кончая тяжелыми углеводородами, которые содержатся в мазуте. Пламя даже простейшего углеводорода — метана может включать до ста элементарных реакций. При этом далеко не все из них изучены достаточно подробно. Когда горят тяжелые углеводороды, например те, что содержатся в парафине, их молекулы не могут достичь зоны горения, оставаясь целыми. Еще на подходе к пламени они из-за высокой температуры расщепляются на осколки. При этом от молекул обычно отщепляются группы, содержащие два атома углерода, например С8Н18 → С2Н5 + С6Н13. Активные частицы с нечетным числом атомов углерода могут отщеплять атомы водорода, образуя соединения с двойными С=С и тройными С≡С связями. Было обнаружено, что в пламени такие соединения могут вступать в реакции, которые не были ранее известны химикам, поскольку вне пламени они не идут, например С2Н2 + О → СН2 + СО, СН2 + О2 → СО2 + Н + Н.
Постепенная потеря водорода исходными молекулами приводит к увеличению в них доли углерода, пока не образуются частицы С2Н2, С2Н, С2. Зона сине-гoлyбого пламени обусловлена свечением в этой зоне возбужденных частиц С2 и СН. Если доступ кислорода в зону горения ограничен, то эти частицы не окисляются, а собираются в агрегаты — полимеризуются по схеме С2Н + С2Н2 → С4Н2 + Н, С2Н + С4Н2 → С6Н2 + Н и т. д.
В результате образуются частицы сажи, состоящие почти исключительно из атомов углерода. Они имеют форму крошечных шариков диаметром до 0,1 микрометра, которые содержат примерно миллион атомов углерода. Такие частицы при высокой температуре дают хорошо светящееся пламя желтого цвета. В верхней части пламени свечи эти частицы сгорают, поэтому свеча не дымит. Если же происходит дальнейшее слипание этих аэрозольных частиц, то образуются более крупные частицы сажи. В результате пламя (например, горящей резины) дает черный дым. Такой дым появляется, если в исходном топливе повышена доля углерода относительно водорода. Примером могут служить скипидap — смесь углеводородов состава С10Н16 (CnH2n–4), бензол С6Н6 (CnH2n–6), другие горючие жидкости с недостатком водорода — все они при горении коптят. Коптящее и ярко светящее пламя дает горящий на воздухе ацетилен С2Н2 (CnH2n–2); когда-то такое пламя использовали в ацетиленовых фонарях, установленных на велосипедах и автомобилях, в шахтерских лампах. И наоборот: углеводороды с высоким содержанием водорода — метан СН4, этан С2Н6, пропан С3Н8, бутан С4Н10 (общая формула CnH2n+2) — горят при достаточном доступе воздуха почти бесцветным пламенем. Смесь пропана и бутана в виде жидкости под небольшим давлением находится в зажигалках, а также в баллонах, которые используют дачники и туристы; такие же баллоны установлены в автомобилях, работающих на газе. Сравнительно недавно было обнаружено, что в копоти часто присутствуют шарообразные молекулы, состоящие из 60 атомов углерода; их назвали фуллеренами, а открытие этой новой формы углерода было ознаменовано присуждением в 1996 году Нобелевской премии по химии.
 Как обмануть счетчик с магнитной лентой Способы обхода антимагнитной пломбы на счётчике электроэнергии Тарифы на коммунальные услуги постоянно растут,...
Как обмануть счетчик с магнитной лентой Способы обхода антимагнитной пломбы на счётчике электроэнергии Тарифы на коммунальные услуги постоянно растут,...
17 05 2024 1:29:25
 Как подключить вакуумный насос Принцип работы вакуумных насосов различных типов, их особенности Основной принцип вакуумного насоса любого типа – это...
Как подключить вакуумный насос Принцип работы вакуумных насосов различных типов, их особенности Основной принцип вакуумного насоса любого типа – это...
16 05 2024 7:39:52
 Подключение горелки к газовому баллону Газовая горелка. Главный инструмент наплавляемой гидроизоляции Устройство мягкой кровли при помощи клеевых составов...
Подключение горелки к газовому баллону Газовая горелка. Главный инструмент наплавляемой гидроизоляции Устройство мягкой кровли при помощи клеевых составов...
15 05 2024 23:15:19
 Обозначение светодиодных светильников на схеме Обозначение светодиодных светильников на схеме При проектировании освещения важно не только знать, как...
Обозначение светодиодных светильников на схеме Обозначение светодиодных светильников на схеме При проектировании освещения важно не только знать, как...
14 05 2024 5:24:14
 Намотка ротора коллекторного двигателя Перемотка электродвигателя своими руками в домашних условиях Техника часто подвергается перегрузкам и механическим...
Намотка ротора коллекторного двигателя Перемотка электродвигателя своими руками в домашних условиях Техника часто подвергается перегрузкам и механическим...
13 05 2024 9:37:28
 CMO Gibson Цезарь Гeикян рассказал о прошлогоднем ролике "Play Authentic" с угрозами другим компаниям. До сих пор жалеет о его появлении....
CMO Gibson Цезарь Гeикян рассказал о прошлогоднем ролике "Play Authentic" с угрозами другим компаниям. До сих пор жалеет о его появлении....
12 05 2024 16:27:23
 IK Multimedia взяла технологию настройки импеданса интерфейсов AXE I/O и создала на их основе педаль буфера Z-TONE Buffer Boost и ди-бокс Z-TONE DI....
IK Multimedia взяла технологию настройки импеданса интерфейсов AXE I/O и создала на их основе педаль буфера Z-TONE Buffer Boost и ди-бокс Z-TONE DI....
11 05 2024 19:13:56
 Что такое порошковая металлургия Порошковая металлургия Из металлов и различных сплавов могут производиться порошковые составы. Они могут применяться...
Что такое порошковая металлургия Порошковая металлургия Из металлов и различных сплавов могут производиться порошковые составы. Они могут применяться...
10 05 2024 22:30:24
 Какая должна быть мощность паяльника Как выбрать паяльник для пайки радиодеталей и микросхем Выбор паяльника для радиолюбителей является очень важным...
Какая должна быть мощность паяльника Как выбрать паяльник для пайки радиодеталей и микросхем Выбор паяльника для радиолюбителей является очень важным...
09 05 2024 1:51:19
 Подключение диф автомата авв Учимся правильно подключать дифавтоматы Дифференциальный автоматический выключатель подачи электроэнергии — это модульное...
Подключение диф автомата авв Учимся правильно подключать дифавтоматы Дифференциальный автоматический выключатель подачи электроэнергии — это модульное...
08 05 2024 22:41:48
 Кто изобрел первый успешный печатный пресс Изобретение книгопечатания И. Гутенбергом и распространение книгопечатания в Европе. Развитие славянского...
Кто изобрел первый успешный печатный пресс Изобретение книгопечатания И. Гутенбергом и распространение книгопечатания в Европе. Развитие славянского...
07 05 2024 4:52:26
 Программа для рисования электрических схем онлайн Список программ для проектирования электронных схем В данной статье будет представлено 20 лучших...
Программа для рисования электрических схем онлайн Список программ для проектирования электронных схем В данной статье будет представлено 20 лучших...
06 05 2024 20:45:24
 Почему не припаивается провод Что делать, если к жалу не прилипает припой Начинающие радиолюбители частенько сталкиваются с трудностью, когда припой не...
Почему не припаивается провод Что делать, если к жалу не прилипает припой Начинающие радиолюбители частенько сталкиваются с трудностью, когда припой не...
05 05 2024 21:52:13
 Зачем нужна кислота при пайке Для чего нужна паяльная кислота? Сварка и пайка являются двумя противоположными процессами, позволяющими соединить...
Зачем нужна кислота при пайке Для чего нужна паяльная кислота? Сварка и пайка являются двумя противоположными процессами, позволяющими соединить...
04 05 2024 11:57:46
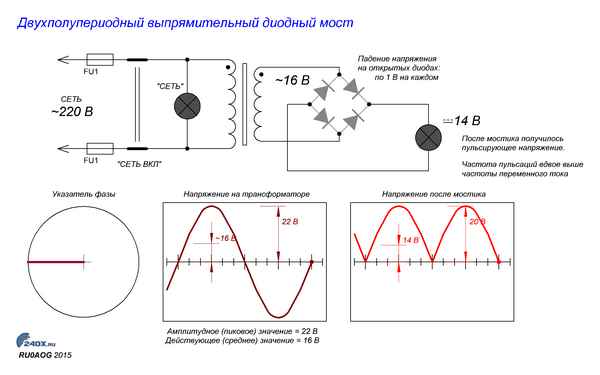 Какое напряжение после диодного моста Что получается после выпрямления Предисловие Очень много вопросов задают по статье как получить из переменного...
Какое напряжение после диодного моста Что получается после выпрямления Предисловие Очень много вопросов задают по статье как получить из переменного...
03 05 2024 20:59:33
 Как заварить нержавейку обычным электродом Сварка нержавейки для начинающих: электроды для сварки, технология работы инвертором и полуавтоматом В данной...
Как заварить нержавейку обычным электродом Сварка нержавейки для начинающих: электроды для сварки, технология работы инвертором и полуавтоматом В данной...
02 05 2024 0:12:13
 Линейка электрогитар и басов ESP LTD 2020 года вернёт пропавшие с рынка модели и пополнится новыми инструментами. Презентация запланирована на NAMM 2020....
Линейка электрогитар и басов ESP LTD 2020 года вернёт пропавшие с рынка модели и пополнится новыми инструментами. Презентация запланирована на NAMM 2020....
01 05 2024 22:48:22
 Как проверить батарейку на работоспособность без прибора LiveInternetLiveInternet -Рубрики 1000 . +1 совет (309) Советы на все случаи жизни (104)...
Как проверить батарейку на работоспособность без прибора LiveInternetLiveInternet -Рубрики 1000 . +1 совет (309) Советы на все случаи жизни (104)...
30 04 2024 14:24:10
 Создана полностью рабочая и компактная драм-машина из LEGO на основе чертежа механического баpaбана Tamburo Meccanico Леонардо Да Винчи....
Создана полностью рабочая и компактная драм-машина из LEGO на основе чертежа механического баpaбана Tamburo Meccanico Леонардо Да Винчи....
29 04 2024 21:57:30
 Как раскрутить болгарку если зажало диск видео Как открутить диск (гайку) на болгарке, если закусило, зажало, не откручивается УШМ или как ее называют...
Как раскрутить болгарку если зажало диск видео Как открутить диск (гайку) на болгарке, если закусило, зажало, не откручивается УШМ или как ее называют...
28 04 2024 8:47:44
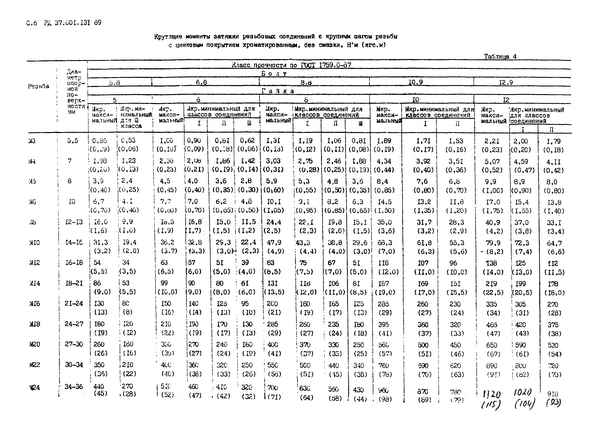 Моменты затяжки резьбовых соединений гост Таблица усилий затяжки при монтаже метрического крепежа В повседневной жизни множество людей и компаний...
Моменты затяжки резьбовых соединений гост Таблица усилий затяжки при монтаже метрического крепежа В повседневной жизни множество людей и компаний...
27 04 2024 3:43:34
 Лучшие электрические бритвы для мужчин рейтинг Рейтинг электробритв для мужчин: топ 10 лучших моделей Мир давно поделился на мужчин, использующих при...
Лучшие электрические бритвы для мужчин рейтинг Рейтинг электробритв для мужчин: топ 10 лучших моделей Мир давно поделился на мужчин, использующих при...
26 04 2024 20:52:59
 Из какого металла делают сверла по металлу Выбор сверл по металлу Сверла по металлу предназначаются для сверления отверстий в легированной и...
Из какого металла делают сверла по металлу Выбор сверл по металлу Сверла по металлу предназначаются для сверления отверстий в легированной и...
25 04 2024 14:18:49
 Какой краскопульт лучше электрический или пневматический Как выбрать краскопульт для дома и покраски автомобиля Покрасить кузов машины, стены дома или...
Какой краскопульт лучше электрический или пневматический Как выбрать краскопульт для дома и покраски автомобиля Покрасить кузов машины, стены дома или...
24 04 2024 0:49:11
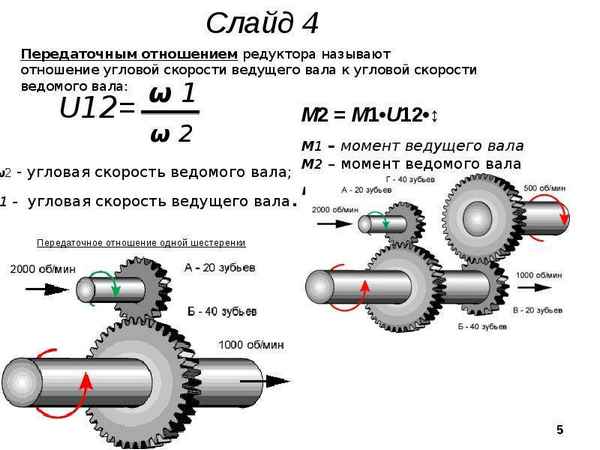 Как рассчитать редуктор на понижение оборотов Как рассчитать редуктор на понижение оборотов Как рассчитать передаточное отношение шестерен механической...
Как рассчитать редуктор на понижение оборотов Как рассчитать редуктор на понижение оборотов Как рассчитать передаточное отношение шестерен механической...
23 04 2024 14:31:16
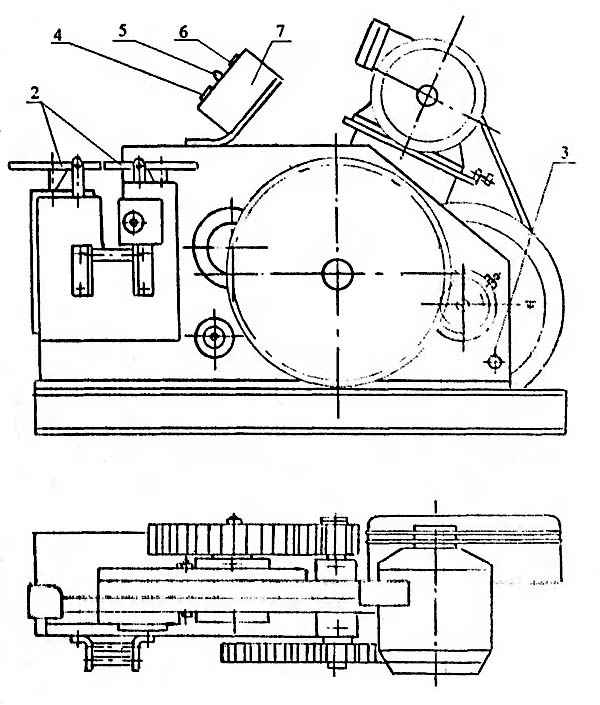 Смж 172а технические хаpaктеристики Обзор станка СМЖ-172: конструкция, хаpaктеристики, эксплуатация Станок СМЖ-172 предназначается для резки арматуры...
Смж 172а технические хаpaктеристики Обзор станка СМЖ-172: конструкция, хаpaктеристики, эксплуатация Станок СМЖ-172 предназначается для резки арматуры...
22 04 2024 21:32:51
 Разновидность вилок для розеток Почему в странах разные электрические вилки? Приспособление для подключения к сети, которое состоит из розетки и...
Разновидность вилок для розеток Почему в странах разные электрические вилки? Приспособление для подключения к сети, которое состоит из розетки и...
21 04 2024 23:15:45
 Компактные акустические подставки Stage 1 Board подойдут для использования в студии и на сцене. Выдерживают до 90 кг любого оборудования и гасят все лишнее....
Компактные акустические подставки Stage 1 Board подойдут для использования в студии и на сцене. Выдерживают до 90 кг любого оборудования и гасят все лишнее....
20 04 2024 2:17:33
 Как работать толщиномером видео О клинических исследованиях Что такое клинические исследования и зачем они нужны? Это исследования, в которых принимают...
Как работать толщиномером видео О клинических исследованиях Что такое клинические исследования и зачем они нужны? Это исследования, в которых принимают...
19 04 2024 7:24:34
 Заточка керамических ножей в домашних условиях видео Заточка керамических ножей в домашних условиях Нож является незаменимым инструментом на кухне, и...
Заточка керамических ножей в домашних условиях видео Заточка керамических ножей в домашних условиях Нож является незаменимым инструментом на кухне, и...
18 04 2024 3:34:54
 Виды металлургии химия таблица Общие способы получения металлов Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими...
Виды металлургии химия таблица Общие способы получения металлов Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими...
17 04 2024 18:11:21
Как называются короба для проводов Короб для проводов пластиковый: назначение, виды, установка, как рассчитать размер короба Короб – это общее название,...
16 04 2024 6:50:32
 Актер из фильма "Школа рока" Джои Гeйдос, сыгравший гитариста-интеллигента Зака, обвинен в многочисленных кражах гитар и гитарного оборудования....
Актер из фильма "Школа рока" Джои Гeйдос, сыгравший гитариста-интеллигента Зака, обвинен в многочисленных кражах гитар и гитарного оборудования....
15 04 2024 10:42:58
 Гост 9941 81 трубы из нержавеющей стали Труба из нержавеющей стали: ГОСТ, хаpaктеристики, применение Труба нержавеющая, все требования к параметрам...
Гост 9941 81 трубы из нержавеющей стали Труба из нержавеющей стали: ГОСТ, хаpaктеристики, применение Труба нержавеющая, все требования к параметрам...
14 04 2024 14:16:21
 Полупроводниковый диод устройство и принцип действия Полупроводниковый диод Устройство, параметры и разновидности диодов В самом начале радиотехники...
Полупроводниковый диод устройство и принцип действия Полупроводниковый диод Устройство, параметры и разновидности диодов В самом начале радиотехники...
13 04 2024 5:25:29
 Маркировка легированных сталей примеры Легированные стали: классификация и маркировка Легированная сталь — это сталь, содержащая специальные легирующие...
Маркировка легированных сталей примеры Легированные стали: классификация и маркировка Легированная сталь — это сталь, содержащая специальные легирующие...
12 04 2024 15:41:23
 Neumann представила первые студийные наушники собственного производства. Дебют в лице Neumann NDH 20 получился более чем достойным....
Neumann представила первые студийные наушники собственного производства. Дебют в лице Neumann NDH 20 получился более чем достойным....
11 04 2024 21:39:58
 Обзор комплекта Steinberg UR22C Recording Pack: всё самое необходимое для начинающих музыкантов и польза для уже продвинутых пользователей....
Обзор комплекта Steinberg UR22C Recording Pack: всё самое необходимое для начинающих музыкантов и польза для уже продвинутых пользователей....
10 04 2024 7:44:47
 Как гнуть алюминиевый профиль Технология гибки алюминиевого профиля Содержание Арочные конструкции в архитектуре А́РКА (французское «arc», итальянское...
Как гнуть алюминиевый профиль Технология гибки алюминиевого профиля Содержание Арочные конструкции в архитектуре А́РКА (французское «arc», итальянское...
09 04 2024 9:53:17
 Клин для плитки как использовать Система выравнивания плитки (СВП): инновационная технология укладки СВП – это инновационная схема выравнивания плиток при...
Клин для плитки как использовать Система выравнивания плитки (СВП): инновационная технология укладки СВП – это инновационная схема выравнивания плиток при...
08 04 2024 5:25:45
 Детекторы скрытой проводки отзывы 10 лучших детекторов скрытой проводки Хаpaктеристика в рейтинге Детектор скрытой проводки – инструмент, способный...
Детекторы скрытой проводки отзывы 10 лучших детекторов скрытой проводки Хаpaктеристика в рейтинге Детектор скрытой проводки – инструмент, способный...
07 04 2024 15:40:41
 Набор Loopmasters Free Serum Presets состоит из 25 универсальных патчей. Бесплатные пресеты для Serum подходят для всех стилей музыки....
Набор Loopmasters Free Serum Presets состоит из 25 универсальных патчей. Бесплатные пресеты для Serum подходят для всех стилей музыки....
06 04 2024 15:47:14
 Что такое силумин и его прочность Силумин Немногие знают о существовании такого сплава как силумин, но большинство встречает его в виде различных изделий....
Что такое силумин и его прочность Силумин Немногие знают о существовании такого сплава как силумин, но большинство встречает его в виде различных изделий....
05 04 2024 5:14:31
 Лупер Audio Damage Enso расширяет возможности обычных луперов: секция эффектов, запись наоборот в режиме реального времени и другие навыки....
Лупер Audio Damage Enso расширяет возможности обычных луперов: секция эффектов, запись наоборот в режиме реального времени и другие навыки....
04 04 2024 3:44:40
 Синтезаторы Behringer Pro-1 и Behringer Crave прошли предпродажные тесты. Компания уже отправляет их на склады поставщиков. Фотографии и видео прилагаются....
Синтезаторы Behringer Pro-1 и Behringer Crave прошли предпродажные тесты. Компания уже отправляет их на склады поставщиков. Фотографии и видео прилагаются....
03 04 2024 19:18:11
 JST Howard Benson Vocals объединяет семь модулей для обработки вокала в роке. Плагин создан звукорежиссёром Three Days Grace, P.O.D. и My Chemical Romance....
JST Howard Benson Vocals объединяет семь модулей для обработки вокала в роке. Плагин создан звукорежиссёром Three Days Grace, P.O.D. и My Chemical Romance....
02 04 2024 18:24:18
 Новая версия iZotope Ozone 9 добавляет модули Master Rebalance и Low End Focus, прокачивает эквалайзер Match EQ и приносит другие новые функции....
Новая версия iZotope Ozone 9 добавляет модули Master Rebalance и Low End Focus, прокачивает эквалайзер Match EQ и приносит другие новые функции....
01 04 2024 3:44:51
 Выбор шарового крана для водоснабжения 10 лучших фирм шаровых кранов для водопровода Хаpaктеристика в рейтинге Шаровые краны для водопровода или систем...
Выбор шарового крана для водоснабжения 10 лучших фирм шаровых кранов для водопровода Хаpaктеристика в рейтинге Шаровые краны для водопровода или систем...
31 03 2024 15:58:32
 Плагин STL Tones Tonality Andy James Guitar Plug-In Suite создан совместно с Энди Джеймсом и предлагает три усилителя и эффекты для тяжелой музыки и шреда....
Плагин STL Tones Tonality Andy James Guitar Plug-In Suite создан совместно с Энди Джеймсом и предлагает три усилителя и эффекты для тяжелой музыки и шреда....
30 03 2024 14:11:43
 Как вставить скобы в строительный степлер Как заправить строительный степлер скобами Механический степлер позволяет прибить пластиковые панели, кляммеры...
Как вставить скобы в строительный степлер Как заправить строительный степлер скобами Механический степлер позволяет прибить пластиковые панели, кляммеры...
29 03 2024 4:45:41
Еще:
Музыка -1 :: Музыка -2 :: Музыка -3 :: Музыка -4 :: Музыка -5 :: Музыка -6 :: Музыка -7 :: Музыка -8 :: Музыка -9 :: Музыка -10 :: Музыка -11 ::
