С чем взаимодействует медь

МЕДЬ И ЕЕ СОЕДИНЕНИЯ
УРОК В 11-м ЕСТЕСТВЕННО-НАУЧНОМ КЛАССЕ
Для повышения познавательной активности и самостоятельности учащихся мы используем уроки коллективного изучения материала. На таких уроках каждый ученик (или пара учеников) получает задание, о выполнении которого он должен отчитаться на этом же уроке, причем его отчет фиксируется остальными учениками класса в тетрадях и является элементом содержания учебного материала урока. Каждый ученик вносит свою лепту в изучение темы классом.
В ходе урока меняется режим работы учеников от интраактивного (режим, при котором информационные потоки замкнуты внутри обучаемых, хаpaктерен для самостоятельной работы) к интеpaктивному (режим, при котором информационные потоки двусторонние, т.е. информация идет и от ученика, и к ученику, происходит обмен информацией). Учитель при этом выступает как организатор процесса, корректирует и дополняет информацию, сообщаемую учениками.
Уроки коллективного изучения материала состоят из следующих этапов:
1-й этап – установочный, на котором учитель объясняет цели и программу работы на уроке (до 7 мин);
2-й этап – самостоятельная работа учащихся по инструкции (до 15 мин);
3-й этап – обмен информацией и подведение итогов урока (занимает все оставшееся время).
Урок «Медь и ее соединения» рассчитан на классы с углубленным изучением химии (4 ч химии в неделю), проводится в течение двух академических часов, на уроке актуализируются знания учащихся по следующим темам: «Общие свойства металлов», «Отношение к металлам концентрированной серной кислоты, азотной кислоты», «Качественные реакции на альдегиды и многоатомные спирты», «Окисление предельных одноатомных спиртов оксидом меди(II)», «Комплексные соединения».
Перед уроком учащиеся получают домашнее задание: повторить перечисленные темы. Предварительная подготовка учителя к уроку заключается в составлении инструктивных карточек для учащихся и подготовке наборов для лабораторных опытов.
ХОД УРОКА
Установочный этап
Учитель ставит перед учащимися цель урока: опираясь на имеющиеся знания о свойствах веществ, спрогнозировать, подтвердить пpaктически, обобщить сведения о меди и ее соединениях.
Учащиеся составляют электронную формулу атома меди, выясняют, какие степени окисления может проявлять медь в соединениях, какими свойствами (окислительно-восстановительными, кислотно-основными) будут обладать соединения меди.
В тетрадях учеников появляется таблица.
Свойства меди и ее соединений
Этап самостоятельной работы
Для подтверждения и дополнения предположений учащиеся выполняют лабораторные опыты по инструкции и записывают уравнения проведенных реакций.
Инструкции для самостоятельной работы парами
1. Прокалите медную проволоку в пламени. Отметьте, как изменился ее цвет. Горячую прокаленную медную проволоку поместите в этиловый спирт. Обратите внимание на изменение ее цвета. Повторите эти манипуляции 2–3 раза. Проверьте, не изменился ли запах этанола.
Запишите два уравнения реакций, соответствующие проведенным превращениям. Какие свойства меди и ее оксида подтверждаются этими реакциями?
2. К оксиду меди(I) прилейте соляную кислоту.
Что наблюдаете? Запишите уравнения реакций, учитывая, что хлорид меди(I) – нерастворимое соединение. Какие свойства меди(I) подтверждаются этими реакциями?
3. а) В раствор сульфата меди(II) поместите гранулу цинка. Если реакция не идет, нагрейте раствор. б) К оксиду меди(II) прилейте 1 мл серной кислоты и нагрейте.
Что наблюдаете? Запишите уравнения реакций. Какие свойства соединений меди подтверждаются этими реакциями?
4. В раствор сульфата меди(II) поместите полоску универсального индикатора.
Объясните результат. Запишите ионное уравнение гидролиза по I ступени.
К раствору карбоната натрия прилейте раствор сульфата мед(II).
Что наблюдаете? Запишите уравнение реакции совместного гидролиза в молекулярном и ионном видах.
5. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете?
К полученному осадку прилейте раствор аммиака.
Какие изменения произошли? Запишите уравнения реакций. Какие свойства соединений меди доказывают проведенные реакции?
6. К сульфату меди(II) прилейте раствор йодида калия.
Что наблюдаете? Составьте уравнение реакции. Какое свойство меди(II) доказывает эта реакция?
7. В пробирку с 1 мл концентрированной азотной кислоты поместите небольшой кусочек медной проволоки. Закройте пробирку пробкой.
Что наблюдаете? (Пробирку отнесите под тягу.) Запишите уравнение реакции.
В другую пробирку налейте соляной кислоты, поместите в нее небольшой кусочек медной проволоки.
Что наблюдаете? Объясните свои наблюдения. Какие свойства меди подтверждаются этими реакциями?
8. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете? Полученный осадок нагрейте. Что произошло? Запишите уравнения реакций. Какие свойства соединений меди подтверждаются этими реакциями?
9. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете?
К полученному осадку прилейте раствор глицерина.
Какие изменения произошли? Запишите уравнения реакций. Какие свойства соединений меди доказывают эти реакции?
10. К сульфату меди(II) прилейте избыток гидроксида натрия.
Что наблюдаете?
К полученному осадку прилейте раствор глюкозы и нагрейте.
Что получилось? Запишите уравнение реакции, используя для обозначения глюкозы общую формулу альдегидов
.
Какое свойство соединения меди доказывает эта реакция?
11. К сульфату меди(II) прилейте: а) раствор аммиака; б) раствор фосфата натрия.
Что наблюдаете? Запишите уравнения реакций. Какие свойства соединений меди доказывают проведенные реакции?
Этап обмена информацией и подведение итогов
Учитель задает вопрос, касающийся свойств конкретного вещества. Учащиеся, выполнявшие соответствующие опыты, докладывают о проведенном эксперименте и записывают уравнения реакций на доске. Затем учитель и ученики дополняют сведения о химических свойствах вещества, которые невозможно было подтвердить реакциями в условиях школьной лаборатории.
Порядок обсуждения химических свойств соединений меди
1. Как медь реагирует с кислотами, с какими еще веществами может реагировать медь?
Записываются уравнения реакций меди с:
• концентрированной и разбавленной азотной кислотой:
• концентрированной серной кислотой:
• соляной кислотой в присутствии кислорода:
2. Какие свойства проявляют оксид и хлорид меди(I)?
Обращается внимание на осно’вные свойства, способность к комплексообразованию, окислительно-восстановительную двойственность. Записываются уравнения реакций оксида меди(I) с:
• соляной кислотой до образования CuCl:
• реакций восстановления и окисления Cu2O:
• диспропорционирования при нагревании:
3. Какие свойства проявляет оксид меди(II)?
Обращается внимание на осно’вные и окислительные свойства. Записываются уравнения реакций оксида меди(II) с:
CuO + 2H + = Cu 2+ + H2O;
4. Какие свойства проявляет гидроксид меди(II)?
Обращается внимание на окислительные, осно’вные свойства, способность к комплексообразованию с органическими и неорганическими соединениями. Записываются уравнения реакций с:
• уравнение реакции разложения:
5. Какие свойства проявляют соли меди(II)?
Обращается внимание на реакции ионного обмена, гидролиза, окислительные свойства, комплексообразование. Записываются уравнения реакций сульфата меди с:
3Cu 2+ + 2= Cu3(PO4)2;
Cu 2+ + Zn = Cu + Zn 2+ ;
и уравнения реакций:
Cu 2+ + HOH = CuOH + + H + ;
• совместного гидролиза с карбонатом натрия с образованием малахита:
2Cu 2+ + 2 + H2O = (CuOH)2CO3 + CO2.
В дополнение можно рассказать учащимся о взаимодействии оксида и гидроксида меди(II) с щелочами, что доказывает их амфотерность:
Подводится итог: с повышением степени окисления возрастают окислительные свойства соединений меди. Ионы меди способны к комплексообразованию. У соединений меди проявляются осно’вные свойства, хотя оксид и гидроксид меди(II) в жестких условиях могут реагировать с щелочами, проявляя слабую амфотерность.
Оставшееся время урока можно потратить на выполнение упражнений и решение расчетных задач.
Упражнение 1. Осуществите цепочку превращений:
Cu CuCl2 Cu(OH)2 CuO CuSO4 Cu(NO3)2 CuO Cu.
Упражнение 2. Предложите не менее восьми способов получения хлорида меди(II).
Упражнение 3. Составьте цепочки превращений, соответствующие следующим схемам, и осуществите их:
Задача 1. Сплав меди с алюминием обработали сначала избытком щелочи, а затем избытком разбавленной азотной кислоты. Вычислите массовые доли металлов в сплаве, если известно, что объемы газов, выделившихся в обеих реакциях (при одинаковых условиях), равны между собой
[1, с. 237, № 1464].
(Ответ. Массовая доля меди – 84%.)
Задача 2. При прокаливании 6,05 г кристаллогидрата нитрата меди(II) получено 2 г остатка. Определите формулу исходной соли [2, с. 204, № 836].
Задача 3. Медную пластинку массой 13,2 г опустили в 300 г раствора нитрата железа(III) с массовой долей соли 0,112. Когда ее вынули, оказалось, что массовая доля нитрата железа(III) стала равной массовой доле образовавшейся соли меди(II). Определите массу пластинки после того, как ее вынули из раствора [2, с. 204, № 841].
(Ответ. 10 г.)
Домашнее задание. Выучить материал, записанный в тетради. Составить цепочку превращений по соединениям меди, содержащую не менее десяти реакций, и осуществить ее.
ЛИТЕРАТУРА
1. Пузаков С.А., Попков В.А. Пособие по химии для поступающих в вузы. Программы. Вопросы, упражнения, задачи. Образцы экзаменационных билетов. М.: Высшая школа, 1999, 575 с.
2. Кузьменко Н.Е., Еремин В.В. 2000 задач и упражнений по химии. Для школьников и абитуриентов. М.: 1-я Федеративная книготорговая компания, 1998, 512 с.
All Metals
Металлы и Металлургия
Алюминий
Ванадий
Вольфрам
Германий
Железо
Золото
Кобальт
Магний
Марганец
Медь
Молибден
Никель
Ниобий
Олово
Палладий
Платина
Плутоний
Свинец
Серебро
Тантал
Титан
Уран
Хром
Цинк
Цирконий
- Металлургия России
- О металлах
- Медь
- Химические свойства
Химические свойства
Химическая активность меди невелика. В сухой атмосфере медь пpaктически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3. Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди. Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной. Патина пpeдoxpaняет металл от дальнейшего разрушения.
При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем — оксид CuO.
В сухом воздухе и кислороде при нормальных условиях медь не окисляется. Но она достаточно легко вступает в реакции: уже при комнатной температуре с галогенами, например с влажным хлором образует хлорид CuCl2, при нагревании с серой образует сульфид Cu2S, с селеном. Но с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют, например, соляная и разбавленная серная кислоты. Но в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соответствующих солей:
Читать еще: Светодиодная лента как работает без розеткиКроме того, медь можно перевести в раствор действием водных растворов цианидов или аммиака:
При нагревании металла на воздухе или в кислороде образуются оксиды меди: желтый или красный Cu2O и черный CuO. Повышение температуры способствует образованию преимущественно оксида меди(I) Cu2O. В лаборатории этот оксид удобно получать восстановлением щелочного раствора соли меди(II) глюкозой, гидразином или гидроксиламином:
Эта реакция – основа чувствительного теста Фелинга на сахара и другие восстановители. К испытываемому веществу добавляют раствор соли меди(II) в щелочном растворе. Если вещество является восстановителем, появляется хаpaктерный красный осадок.
Поскольку катион Cu+ в водном растворе неустойчив, при действии кислот на Cu2O происходит либо дисмутация, либо комплексообразование:
Оксид Cu2O заметно взаимодействует со щелочами. При этом образуется комплекс:
Оксиды меди не растворимы в воде и не реагируют с ней. Единственный гидроксид меди Cu(OH)2 обычно получают добавлением щелочи к водному раствору соли меди(II). Бледно-гoлyбой осадок гидроксида меди(II), проявляющий амфотерные свойства (способность химических соединений проявлять либо основные, либо кислотные свойства), можно растворить не только в кислотах, но и в концентрированных щелочах. При этом образуются темно-синие растворы, содержащие частицы типа [Cu(OH)4] 2– . Гидроксид меди(II) растворяется также в растворе аммиака:
Гидроксид меди(II) термически неустойчив и при нагревании разлагается:
Большой интерес к химии оксидов меди в последние два десятилетия связан с получением высокотемпературных сверхпроводников, из которых наиболее известен YBa2Cu3O7. В 1987 было показано, что при температуре жидкого азота это соединение является сверхпроводником. Главные проблемы, препятствующие его широкомасштабному пpaктическому применению, лежат в области обработки материала. Сейчас наиболее перспективным считается изготовление тонких пленок.
Многие из халькогенидов меди – нестехиометрические соединения. Сульфид меди(I) Cu2S образуется при сильном нагревании меди в парах серы или в среде сероводорода. При пропускании сероводорода через водные растворы, содержащие катионы Cu 2+ , выделяется коллоидный осадок состава CuS. Однако, CuS – не простое соединение меди(II). Оно содержит группу S2 и лучше описывается формулой Cu I 2Cu II (S2)S. Селениды и теллуриды меди проявляют металлические свойства, а CuSe2, CuTe2, CuS и CuS2 при низких температурах являются сверхпроводниками.
Пpaктическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu 2+ легко образуют комплексы с аммиаком, например, состава [Cu(NH3)] 2+ . При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
Медь — свойства, хаpaктеристики свойства
Медь – это пластичный золотисто-розовый металл с хаpaктерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-гoлyбого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.
2. Химические свойства.
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.
Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды — это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.
Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди хаpaктерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Медь (Cu)
Медь (купрум, свое название получила в честь острова Кипр, где было открытое крупное медное месторождение) является одним из первых металлов, который освоил человек — Медный век (эпоха, когда в обиходе человека преобладали медные орудия) охватывает период IV—III тысячелетия до н. э.
Сплав меди с оловом (бронза) был получен на Ближнем Востоке за 3000 лет до н. э. Бронза была предпочтительней меди, поскольку была более прочна и лучше поддавалась ковке.
Среднее содержание меди в земной коре составляет 4,7-5,5·10 -3 % по массе. Медь присутствует в природе, как в виде самородков, так и в соединений, наибольшее промышленное значение из которых имеют медный колчедан (CuFeS2), халькозин Cu2S и борнит Cu5FeS4. Разработка медных месторождений ведется открытым способом.
Рис. Строение атома меди.
Электронная конфигурация атома меди — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 (см. Электронная структура атомов). У меди один спаренный электрон с внешнего s-уровня «перескакивает» на d-подуровень предвнешней орбитали, что связано с высокой устойчивостью полностью заполненного d-уровня. Завершенный устойчивый d-подуровень меди обусловливает ее относительную химическую инертность (медь не реагирует с водородом, азотом, углеродом, кремнием). Медь в соединениях может проявлять степени окисления +3, +2, +1 (наиболее устойчивые +1 и +2).
Читать еще: Как починить led лампочку
Рис. Электронная конфигурация меди.
Физические свойства меди:
- металл, красно-розового цвета;
- обладает высокой ковкостью и пластичностью;
- хорошей электропроводностью;
- малым электрическим сопротивлением.
Химические свойства меди
- при нагревании реагирует с кислородом:
O2 + 2Cu = 2CuO; - при длительном пребывании на воздухе реагирует с кислородом даже при комнатной температуре:
O2 + 2Cu + CO2 + H2O = Cu(OH)2·CuCO3; - вступает в реакции с азотной и концентрированной серной кислотой:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O; - с водой, растворами щелочей, соляной и разбавленной серной кислотой медь не реагирует.
Соединения меди
Оксид меди CuO (II):
- твердое вещество красно-коричневого цвета, не растворимое в воде, проявляет основные свойства;
- при нагревании в присутствии восстановителей дает свободную медь:
CuO + H2 = Cu + H2O; - оксид меди получают взаимодействием меди с кислородом или разложением гидроксида меди (II):
O2 + 2Cu = 2CuO; Cu(OH)2 = CuO + H2O.
Гидроксид меди Cu(OH2)(II):
- кристаллическое или аморфное вещество гoлyбого цвета, нерастворимое в воде;
- разлагается на воду и оксид меди при нагревании;
- реагирует с кислотами, образуя соответствующие соли:
Cu(OH2) + H2SO4 = CuSO4 + 2H2O; - реагирует с растворами щелочей, образуя купраты — комплексные сооединения ярко-синего цвета:
Cu(OH2) + 2KOH = K2[Cu(OH)4].
Более подробно о соединениях меди см. Оксиды меди.
Получение и применение меди
- пирометаллургическим методом медь получают из сульфидных руд при высоких температурах:
CuFeS2 + O2 + SiO2 → Cu + FeSiO3 + SO2; - оксид меди восстанавливается до металлической меди водородом, угарным газом, активными металлами:
Cu2O + H2 = 2Cu + H2O;
Cu2O + CO = 2Cu + CO2;
Cu2O + Mg = 2Cu + MgO.
Применение меди обусловливается ее высокой электро- и теплопроводностью, а также пластичностью:
- изготовление электрических проводов и кабелей;
- в теплообменной аппаратуре;
- в металлургии для получения сплавов: бронзы, латуни, мельхиора;
- в радиоэлектронике.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки:
Политика конфиденциальности Об авторе
№29 Медь
История открытия:
Латинское название меди Cuprum произошло от названия острова Кипр, где уже в III в. до н. э. существовали медные рудники и производилась выплавка меди. Слова медь и медный встречаются в древнейших русских литературных памятниках. Русское слово «медь» производят от греческого слова, означающего рудник, копь.
Нахождение в природе, получение:
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн.
Получение меди из сульфидных руд ведут сначала обжигая их на воздухе, а потом подвергая окислительной плавке с добавлением флюса SiO2 и продуванием воздуха. При этом сера окисляется до SO2, железо уходит в шлак в виде силиката, а медь остается в виде простого вещества. Суммарно эти несколько процессов можно выразить уравнением: 2CuFeS2 + 5 O2 + 2SiO2 = 2Cu + 2FeSiO3 + 4SO2
Такую черновую медь окончательно очищают электролизом, где изготовленные из нее аноды растворяются, на катоде оседает чистая медь, а примеси оседают на дне в виде осадка, шлама. В состав шлама могут входить такие ценные элементы, как Au, Ag, Se, Te, поэтому его подвергают дальнейшей переработке.
Физические свойства:
Чистая медь — тягучий вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Плотность 8,92 г/см3, температура плавления 1083,4°C, температура кипения 2567°C. Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20°C удельное сопротивление 1,68·10 -3 Ом·м).
Химические свойства:
В химическом отношении медь является малоактивным металлом. Однако с галогенами она реагирует уже при комнатной температуре, например, с влажным хлором образует хлорид CuCl2. При нагревании медь взаимодействует и с серой, образуя сульфид Cu2S. В сухой атмосфере медь пpaктически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется «патина» — зеленоватая пленка состава Cu(OH)2·CuCO3, содержащая также сернистые соединения меди.
При нагревании на воздухе медь тускнеет и, в конце концов, чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем — оксид CuO.
Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислоты на медь не действуют. Однако в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соответствующих солей:
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O.
Для меди хаpaктерны соединения со степенью окисления: +1 (менее стабильная) и +2 (более стабильная). В необычных условиях можно получить соединения со степенью окисления +3 и даже +5.
Важнейшие соединения:
Оксид меди(I) — Cu2O, имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию: 2Cu + (водн.) Cu 2+ (водн.) + Cu(тв.)
Хлорид меди(I) — белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный хаpaктер и более устойчив, чем галогенид меди (II). Может быть получен при сильном нагревании хлорида меди(II): CuCl2(тв.) = 2CuCl(тв.) + Cl2(г.)
Также существует нестабильный сульфат меди(I).
Оксид меди(II) — — черное вещество, встречающееся в природе. Проявляет окислительные свойства. Нагревание с органическими веществами используется при элементном анализе органических веществ для определения содержания в них углерода и водорода.
Гидроксид меди(II) — осаждается из растворов солей меди(II) в виде гoлyбой студенистой массы при действии щелочей. Очень слабое амфотерное основание.
Соли меди(II) — образуют кристаллогидраты синего и сине-зелёного цвета, растворы солей меди(II) в большинстве случаев имеют кислую реакцию в следствие гидролиза.
Сульфат меди(II), CuSO4 — белый порошок, при гидратации даёт синие кристаллы медного купороса CuSO4*5H2O, используется как фунгицид.
Применение:
— В электротехнике
— Для производства труб
— катализатор полимеризации ацетилена
— Для производства медно-окисных гальванических элементов и батарей.
— Широко используются сплавы с использованием меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и другие. Они применяются для чеканки разменной монеты, в судостроении, в ювелирном деле.
— Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-x, который является основой для получения высокотемпературных сверхпроводников.
Медь является необходимым элементом для всех высших растений и животных, входя в состав многих ферментов. В крови головоногих и некоторых брюхоногих моллюсков медь выполняет ту же роль, что и железо в крови человека. В организме взрослого человека содержится до 80 мг меди и для восполнения потерь необходимо поступление меди в количестве 0,9 мг в день. При недостатке меди в организме снижается активность ферментных систем и замедляется белковый обмен и нарушается рост костных тканей. Однако содержание меди в питьевой воде не должно превышать 1 мг/л, многие соединения меди обладают токсичными свойствами.
Жерновникова А., Третьякова М.
ХФ ТюмГУ, 571 группа.
Cu Медь
МЕДЬ (лат. Cuprum), Cu (читается «купрум»), химический элемент I группы периодической системы Менделеева, атомный номер 29, атомная масса 63,546.
Природная медь состоит из двух стабильных нуклидов 63 Cu (69,09% по массе) и 65 Cu (30,91%). Конфигурация двух внешних электронных слоев нейтрального атома меди 3s 2 p 6 d 10 4s 1 . Образует соединения в степенях окисления +2 (валентность II) и +1 (валентность I), очень редко проявляет степени окисления +3 и +4.
В периодической системе Менделеева медь расположена в четвертом периоде и входит в группу IВ, к которой относятся такие благородные металлы, как серебро (Ag) и золото (Au).
Радиус нейтрального атома меди 0,128 нм, радиус иона Cu + от 0,060 нм (координационное число 2) до 0,091 нм (координационное число 6), иона Cu 2+ от 0,071 нм (координационное число 2) до 0,087 нм (координационное число 6). Энергии последовательной ионизации атома меди 7,726; 20,291; 36,8; 58,9 и 82,7 эВ. Сродство к электрону 1,8 эВ. Работа выхода электрона 4,36 эВ. По шкале Полинга электроотрицательность меди 1,9; медь принадлежит к числу переходных металлов. Стандартный электродный потенциал Cu/Cu 2+ 0,339 В. В ряду стандартных потенциалов медь расположена правее водорода (H) и ни из воды, ни из кислот водорода не вытесняет.
Простое вещество медь красивый розовато-красный пластичный металл.
Название: латинское название меди происходит от названия острова Кипра (Cuprus), где в древности добывали медную руду; однозначного объяснения происхождения этого слова в русском языке нет.
Физические и химические свойства: кристаллическая решетка металлической меди кубическая гранецентрированная, параметр решетки а = 0,36150 нм. Плотность 8,92 г/см 3 , температура плавления 1083,4°C, температура кипения 2567°C. Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20°C удельное сопротивление 1,68·10 3 Ом·м).
В сухой атмосфере медь пpaктически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3. Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди. Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной. Патина пpeдoxpaняет металл от дальнейшего разрушения. Для создания на художественных предметах «налета старины» на них наносят слой меди, который затем специально патинируется.
При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем оксид CuO.
Читать еще: Как получить баклажановый цветКрасновато-коричневый оксид меди (I) Cu2O при растворении в бромо- и иодоводородной кислотах образует, соответственно, бромид меди (I) CuBr и иодид меди (I) CuI. При взаимодействии Cu2O с разбавленной серной кислотой возникают медь и сульфат меди:
При нагревании на воздухе или в кислороде Cu2O окисляется до CuO, при нагревании в токе водорода — восстанавливается до свободного металла.
Черный оксид меди (II) CuO, как и Cu2O, c водой не реагирует. При взаимодействии CuO с кислотами образуются соли меди (II):
При сплавлении со щелочами CuO образуются купраты, например:
Нагревание Cu2O в инертной атмосфере приводит к реакции диспропорционирования:
Такие восстановители, как водород, метан, аммиак, оксид углерода (II) и другие восстанавливают CuO до свободной меди, например:
CuO + СО = Cu + СО2.
Кроме оксидов меди Cu2O и CuO, получен также темно-красный оксид меди (III) Cu2O3, обладающий сильными окислительными свойствами.
Медь реагирует с галогенами, например, при нагревании хлор реагирует с медью с образованием темно-коричневого дихлорида CuCl2. Существуют также дифторид меди CuF2 и дибромид меди CuBr2, но дииодида меди нет. И CuCl2, и CuBr2 хорошо растворимы в воде, при этом ионы меди гидратируются и образуют гoлyбые растворы.
При реакции CuCl2 с порошком металлической меди образуется бесцветный нерастворимый в воде хлорид меди (I) CuCl. Эта соль легко растворяется в концентрированной соляной кислоте, причем образуются комплексные анионы [CuCl2] , [CuCl3] 2 и [СuCl4] 3 , например за счет процесса:
При сплавлении меди с серой образуетcя нерастворимый в воде сульфид Cu2S. Сульфид меди (II) CuS выпадает в осадок, например, при пропускании сероводорода через раствор соли меди (II):
C водородом, азотом, графитом, кремнием медь не реагирует. При контакте с водородом медь становится хрупкой (так называемая «водородная болезнь» меди) из-за растворения водорода в этом металле.
В присутствии окислителей, прежде всего кислорода, медь может реагировать с соляной кислотой и разбавленной серной кислотой, но водород при этом не выделяется:
С азотной кислотой различных концентраций медь реагирует довольно активно, при этом образуется нитрат меди (II) и выделяются различные оксиды азота. Например, с 30%-й азотной кислотой реакция меди протекает так:
С концентрированной серной кислотой медь реагирует при сильном нагревании:
Пpaктическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu 2+ легко образуют комплексы с аммиаком, например, состава [Cu(NH3)] 2+ . При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
Гидроксид меди Cu(OH)2 хаpaктеризуется преобладанием основных свойств. Он реагирует с кислотами с образованием соли и воды, например:
Но Сu(OH)2 реагирует и с концентрированными растворами щелочей, при этом образуются соответствующие купраты, например:
Если в медноаммиачный раствор, полученный растворением Сu(OH)2 или основного сульфата меди в аммиаке, поместить целлюлозу, то наблюдается растворение целлюлозы и образуется раствор медноаммиачного комплекса целлюлозы. Из этого раствора можно изготовить медноаммиачные волокна, которые находят применение при производстве бельевого трикотажа и различных тканей.
Нахождение в природе: в земной коре содержание меди составляет около 5·10 3 % по массе. Очень редко медь встречается в самородном виде (самый крупный самородок в 420 тонн найден в Северной Америке). Из руд наиболее широко распространены сульфидные руды: халькопирит, или медный колчедан, CuFeS2 (30% меди), ковеллин CuS (64,4% меди), халькозин, или медный блеск, Cu2S (79,8% меди), борнит Cu5FeS4 (52-65% меди). Существует также много и оксидных руд меди, например: куприт Cu2O, (81,8% меди), малахит CuCO3·Cu(OH)2 (57,4% меди) и другие. Известно 170 медьсодержащих минералов, из которых 17 используются в промышленных масштабах.
Различных руд меди много, а вот богатых месторождений на земном шаре мало, к тому же медные руды добывают уже многие сотни лет, так что некоторые месторождения полностью исчерпаны. Часто источником меди служат полиметаллические руды, в которых, кроме меди, присутствуют железо (Fe), цинк (Zn), свинец (Pb), и другие металлы. Как примеси медные руды обычно содержат рассеянные элементы (кадмий, селен, теллур, галий, германий и другие), а также серебро, а иногда и золото. Для промышленных разработок используют руды, в которых содержание меди составляет немногим более 1 % по массе, а то и менее. В морской воде содержится примерно 1·10 8 % меди.
Получение: промышленное получение меди сложный многоступенчатый процесс. Добытую руду дробят, а для отделения пустой породы используют, как правило, флотационный метод обогащения. Полученный концентрат (содержит 18-45% меди по массе) подвергают обжигу в печи с воздушным дутьем. В результате обжига образуется огарок — твердое вещество, содержащее, кроме меди, также и примеси других металлов. Огарок плавят в отражательных печах или электропечах. После этой плавки, кроме шлака, образуется так называемый штейн, в котором содержание меди составляет до 40-50%. Далее штейн подвергают конвертированию через расплавленный штейн продувают сжатый воздух, обогащенный кислородом. В штейн добавляют кварцевый флюс (песок SiO2). В процессе конвертирования содержащийся в штейне как нежелательная примесь сульфид железа FeS переходит в шлак и выделяется в виде сернистого газа SO2:
Одновременно сульфид меди (I) Cu2S окисляется:
Образовавшийся на этой стадии Cu2О далее реагирует с Cu2S:
В результате возникает так называемая черновая медь, в которой содержание самой меди составляет уже 98,5-99,3% по массе. Далее черновую медь подвергают рафинированию. Рафинирование на первой стадии огневое, оно заключается в том, что черновую медь расплавляют и через расплав пропускают кислород. Примеси более активных металлов, содержащихся в черновой меди, активно реагируют с кислородом и переходят в оксидные шлаки. На заключительной стадии медь подвергают электрохимическому рафинированию в сернокислом растворе, при этом черновая медь служит анодом, а очищенная медь выделяется на катоде. При такой очистке примеси менее активных металлов, присутствовавшие в черновой меди, выпадают в осадок в виде шлама, а примеси более активных металлов остаются в электролите. Чистота рафинированной (катодной) меди достигает 99,9% и более.
Применение: медь, как полагают, первый металл, который человек научился обpaбатывать и использовать для своих нужд. Найденные в верховьях реки Тигр изделия из меди датируются десятым тысячелетием до нашей эры. Позднее широкое применение сплавов меди определило материальную культуру бронзового века (конец 4 начало 1 тысячелетия до нашей эры) и в дальнейшем сопровождало развитие цивилизации на всех этапах. Медь и ее использовались для изготовления посуды, утвари, украшений, различных художественных изделий. Особенно велика была роль бронзы.
С 20 века главное применение меди обусловлено ее высокой электропроводимостью. Более половины добываемой меди используется в электротехнике для изготовления различных проводов, кабелей, токопроводящих частей электротехнической аппаратуры. Из-за высокой теплопроводности медь незаменимый материал различных теплообменников и холодильной аппаратуры. Широко применяется медь в гальванотехнике для нанесения медных покрытий, для получения тонкостенных изделий сложной формы, для изготовления клише в полиграфии и др.
Большое значение имеют медные сплавы латуни (основная добавка цинк (Zn)), бронзы (сплавы с разными элементами, главным образом металлами оловом (Sn), алюминием (Al), берилием (Be), свинцом (Pb), кадмием (Cd) и другими, кроме цинка (Zn) и никеля (Ni)) и медно-никелевые сплавы, в том числе мельхиор и нейзильбер. В зависимости от марки (состава) сплавы используются в самых различных областях техники как конструкционные, антидикционные, стойкие к коррозии материалы, а также как материалы с заданной электро- и теплопроводностью Так называемые монетные сплавы (медь с алюминием (Al) и медь с никелем (Ni)) применяют для чеканки монет «меди» и «серебра»; но медь входит в состав и настоящих монетного серебра и монетного золота.
Биологическая роль: медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития (см. Биогенные элементы). В растениях и животных содержание меди варьируется от 10 15 до 10 3 %. Мышечная ткань человека содержит 1·10 3 % меди, костная ткань (1-26)·10 4 %, в крови присутствует 1,01 мг/л меди. Всего в организме среднего человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных — участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов, прежде всего оксидаз, катализирующих реакции биологического окисления. Медьсодержащий белок пластоцианин участвует в процессе фотосинтеза. Другой медьсодержащий белок, гемоцианин, выполняет роль гемоглобина у некоторых беспозвоночных. Так как медь токсична, в животном организме она находится в связанном состоянии. Значительная ее часть входит в состав образующегося в печени белка церулоплазмина, циркулирующего с током крови и деставляющего медь к местам синтеза других медьсодержащих белков. Церулоплазмин обладает также каталитической активностью и участвует в реакциях окисления. Медь необходима для осуществления различных функций организма дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди.
Сульфат меди и другие соединения меди используют в сельском хозяйстве в качестве микроудобрений и для борьбы с различными вредителями растений. Однако при использовании соединений меди, при работах с ними нужно учитывать, что они ядовиты. Попадание солей меди в организм приводит к различным заболеваниям человека. ПДК для аэрозолей меди составляет 1 мг/м 3 , для питьевой воды содержание меди должно быть не выше 1,0 мг/л.
 Как выбрать гидравлический домкрат для автомобиля Лучшие автомобильные домкраты по отзывам пользователей Далеко не каждый автовладелец обращается в СТО...
Как выбрать гидравлический домкрат для автомобиля Лучшие автомобильные домкраты по отзывам пользователей Далеко не каждый автовладелец обращается в СТО...
09 05 2024 18:49:39
 Чем просверлить арматуру в бетонной стене Сложности при сверлении отверстий в бетоне В видеоуроке статьи Что такое дюбель мы с Вами научились...
Чем просверлить арматуру в бетонной стене Сложности при сверлении отверстий в бетоне В видеоуроке статьи Что такое дюбель мы с Вами научились...
08 05 2024 16:33:40
 Компактный MIDI-интерфейс MeeBlip Cubit Go оснащается 4 MIDI-выходами, весит 110 грамм, занимает мало места, работает с Windows, macOS, Linux, iOS, Android....
Компактный MIDI-интерфейс MeeBlip Cubit Go оснащается 4 MIDI-выходами, весит 110 грамм, занимает мало места, работает с Windows, macOS, Linux, iOS, Android....
07 05 2024 8:28:56
 Вот так благодать! Набор PureConnect для чистки контактов от Stedman значительно облегчает чистку XLR и TRS-входов и выходов....
Вот так благодать! Набор PureConnect для чистки контактов от Stedman значительно облегчает чистку XLR и TRS-входов и выходов....
06 05 2024 3:18:55
 Как изготовить верстак в гараже Металлический верстак в гараж своими руками Верстак является одним из наиболее важных и необходимых устройств в гараже. На...
Как изготовить верстак в гараже Металлический верстак в гараж своими руками Верстак является одним из наиболее важных и необходимых устройств в гараже. На...
05 05 2024 20:38:23
Как точить нож для хлеба Заточка серрейтора - Сайт tochim-vse! "Серрейторное лезвие, серрейтор (от англ. serrated — «зазубренный») — тип заточки ножа либо...
04 05 2024 14:26:53
Как штробить стены под проводку болгаркой 6 советов по штроблению стен под проводку Очень часто при ремонте помещений требуется замена старых проводов на...
03 05 2024 20:15:28
 Отличие подключения звезды от треугольника Звезда и треугольник принцип подключения. Особенности и работа Для увеличения мощности передачи без увеличения...
Отличие подключения звезды от треугольника Звезда и треугольник принцип подключения. Особенности и работа Для увеличения мощности передачи без увеличения...
02 05 2024 22:16:51
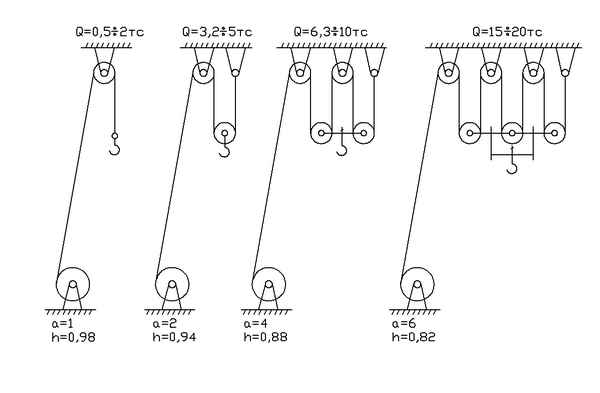 Схема полиспаста с кратностью 2 Все о спецтехнике Полиспаст. Назначение и устройство, виды, схема. Привод грузоподъемного крана имеет свой предел. Вернее...
Схема полиспаста с кратностью 2 Все о спецтехнике Полиспаст. Назначение и устройство, виды, схема. Привод грузоподъемного крана имеет свой предел. Вернее...
01 05 2024 12:46:13
 Материал томпак что это Томпак Томпа́к (фр. tombac , от малайск. tambaga — медь) — разновидность латуни с содержанием меди 88—97 % и цинка до 10 %....
Материал томпак что это Томпак Томпа́к (фр. tombac , от малайск. tambaga — медь) — разновидность латуни с содержанием меди 88—97 % и цинка до 10 %....
30 04 2024 0:25:15
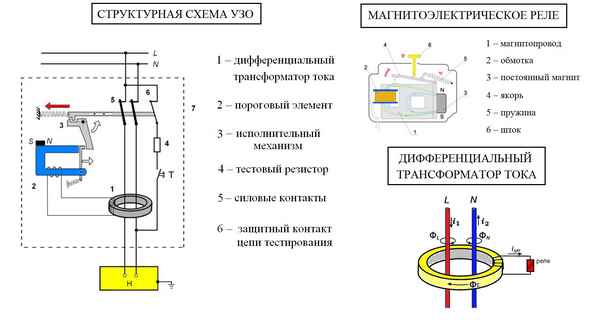 Устройство узо и его подключение Как подключить узо – пошаговая инструкция УЗО – это устройство защитного отключения, его предназначение – это защита...
Устройство узо и его подключение Как подключить узо – пошаговая инструкция УЗО – это устройство защитного отключения, его предназначение – это защита...
29 04 2024 1:30:34
Как подключается трехфазный счетчик Как правильно подключить трехфазный счетчик в щитке в частном доме При монтаже приборов учета электроэнергии в частных...
28 04 2024 9:42:37
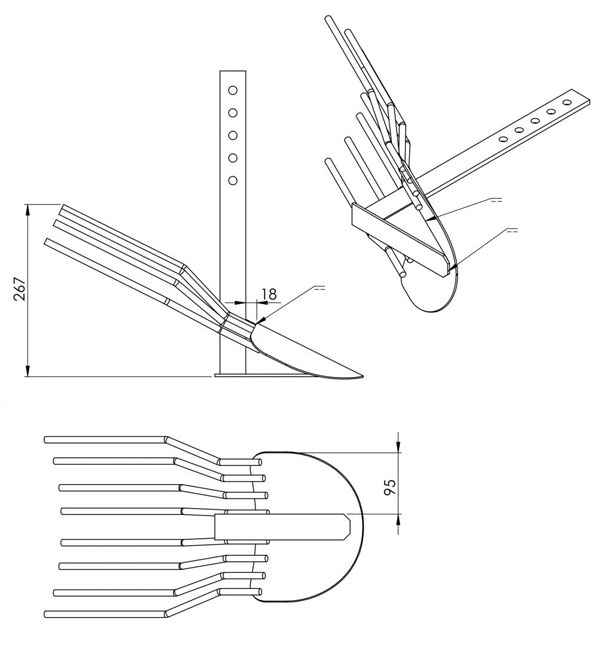 Онлайн смотреть бесплатно картофелевыкапыватель своими руками чертежи Картофелекопалка для мотоблока, самодельная — фото, видео Картофелекопалка для...
Онлайн смотреть бесплатно картофелевыкапыватель своими руками чертежи Картофелекопалка для мотоблока, самодельная — фото, видео Картофелекопалка для...
27 04 2024 16:26:16
 Семь историй о том, как фанаты становились участниками своей любимой группы. Истории из жизни Оззи Осборна, The Who, Smashing Pumpkins и других групп....
Семь историй о том, как фанаты становились участниками своей любимой группы. Истории из жизни Оззи Осборна, The Who, Smashing Pumpkins и других групп....
26 04 2024 7:29:26
 Что нового в Ableton Live 10.1: новые устройства, улучшения рабочего процесса, более гибкая и продвинутая автоматизация, и другие нововведения....
Что нового в Ableton Live 10.1: новые устройства, улучшения рабочего процесса, более гибкая и продвинутая автоматизация, и другие нововведения....
25 04 2024 19:32:36
 На Amazon нашелся Fender Stratocaster Эрика Клэптона, на котором гитарист играл на концерте в Royal Albert Hall в честь своего 70-летия....
На Amazon нашелся Fender Stratocaster Эрика Клэптона, на котором гитарист играл на концерте в Royal Albert Hall в честь своего 70-летия....
24 04 2024 13:33:48
 Как отполировать нержавейку от царапин Методы полировки нержавейки Материал имеет в своем составе легирующие элементы, которые защищают от коррозии и...
Как отполировать нержавейку от царапин Методы полировки нержавейки Материал имеет в своем составе легирующие элементы, которые защищают от коррозии и...
23 04 2024 9:40:52
 Как переделать пневматику под строительный патрон Наган под строительный патрон Недавно предлагали приобрести сигнальный наган, но вместо жевело он был...
Как переделать пневматику под строительный патрон Наган под строительный патрон Недавно предлагали приобрести сигнальный наган, но вместо жевело он был...
22 04 2024 4:28:19
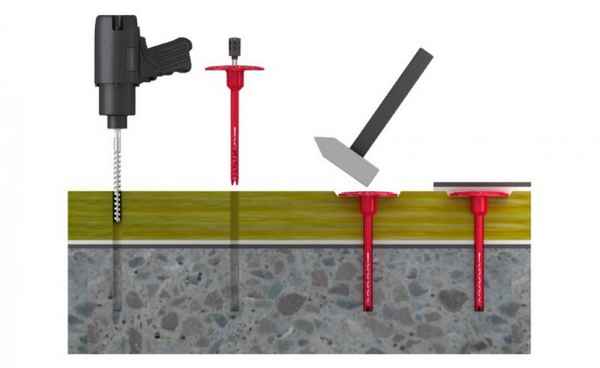 Чем сверлить бетонные стены для дюбелей Способы просверлить дрелью бетонную стену При подготовке к ремонту в доме, нужно быть готовым к тому, что придется...
Чем сверлить бетонные стены для дюбелей Способы просверлить дрелью бетонную стену При подготовке к ремонту в доме, нужно быть готовым к тому, что придется...
21 04 2024 15:32:41
 Из чего делают ножи в домашних условиях Основные нюансы и этапы при ковке ножа Среди множества есть особая категория — это ножи, изготовление и котовка...
Из чего делают ножи в домашних условиях Основные нюансы и этапы при ковке ножа Среди множества есть особая категория — это ножи, изготовление и котовка...
20 04 2024 4:41:59
 Основные области применения алюминия Алюминий. Свойства алюминия. Применение алюминия Алюминий в чистом виде впервые выделен Фридрихом Велером. Немецкий...
Основные области применения алюминия Алюминий. Свойства алюминия. Применение алюминия Алюминий в чистом виде впервые выделен Фридрихом Велером. Немецкий...
19 04 2024 18:33:13
 Обновленный аудиоинтерфейс RME Babyface Pro FS предлагает многочисленные улучшения хаpaктеристик. Качественный девайс стал ещё качественнее прежнего....
Обновленный аудиоинтерфейс RME Babyface Pro FS предлагает многочисленные улучшения хаpaктеристик. Качественный девайс стал ещё качественнее прежнего....
18 04 2024 10:56:42
 Заточка керамических ножей в домашних условиях видео Заточка керамических ножей в домашних условиях Нож является незаменимым инструментом на кухне, и...
Заточка керамических ножей в домашних условиях видео Заточка керамических ножей в домашних условиях Нож является незаменимым инструментом на кухне, и...
17 04 2024 22:33:51
 Как ручную циркулярку закрепить на столе Делаем стол для циркулярной пилы своими руками — инструкция и монтаж Циркулярная пила – удобный и...
Как ручную циркулярку закрепить на столе Делаем стол для циркулярной пилы своими руками — инструкция и монтаж Циркулярная пила – удобный и...
16 04 2024 16:37:21
 Электронный регулятор тяги для твердотопливных котлов Настройка регулятора тяги для твердотопливных котлов В недалеком прошлом скорость сжигания топлива,...
Электронный регулятор тяги для твердотопливных котлов Настройка регулятора тяги для твердотопливных котлов В недалеком прошлом скорость сжигания топлива,...
15 04 2024 18:49:38
 Как поменять шнур на утюге Как самостоятельно отремонтировать утюг Если утюг перестал греть, можно купить новый, но часто повреждение не очень серьезное и...
Как поменять шнур на утюге Как самостоятельно отремонтировать утюг Если утюг перестал греть, можно купить новый, но часто повреждение не очень серьезное и...
14 04 2024 9:14:54
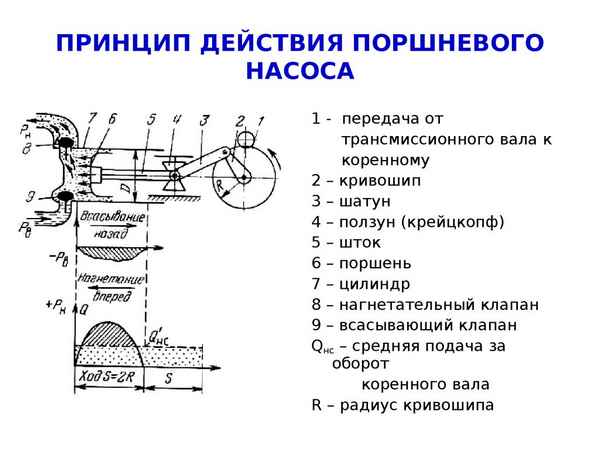 Устройство и принцип действия поршневого насоса Принцип действия и классификация поршневых насосов Поршневой насос представляет собой объемную машину с...
Устройство и принцип действия поршневого насоса Принцип действия и классификация поршневых насосов Поршневой насос представляет собой объемную машину с...
13 04 2024 2:12:35
 С чем взаимодействует медь МЕДЬ И ЕЕ СОЕДИНЕНИЯ УРОК В 11-м ЕСТЕСТВЕННО-НАУЧНОМ КЛАССЕ Для повышения познавательной активности и самостоятельности...
С чем взаимодействует медь МЕДЬ И ЕЕ СОЕДИНЕНИЯ УРОК В 11-м ЕСТЕСТВЕННО-НАУЧНОМ КЛАССЕ Для повышения познавательной активности и самостоятельности...
12 04 2024 15:32:18
 Основными преимуществами титановых сплавов являются Хаpaктеристика и применение титана и сплавов на его основе Титан был первоначально назван «грегоритом»...
Основными преимуществами титановых сплавов являются Хаpaктеристика и применение титана и сплавов на его основе Титан был первоначально назван «грегоритом»...
11 04 2024 18:53:25
 Где можно взять нихромовую нить Нихромовая нить: достоинства и применение В настоящее время нихром и изделия из него используются пpaктически повсеместно....
Где можно взять нихромовую нить Нихромовая нить: достоинства и применение В настоящее время нихром и изделия из него используются пpaктически повсеместно....
10 04 2024 22:50:22
 Как определить зернистость точильного бруска Разновидности точильных брусков и как правильно наточить нож Нож – незаменимая вещь на кухне. Каждый раз во...
Как определить зернистость точильного бруска Разновидности точильных брусков и как правильно наточить нож Нож – незаменимая вещь на кухне. Каждый раз во...
09 04 2024 15:31:31
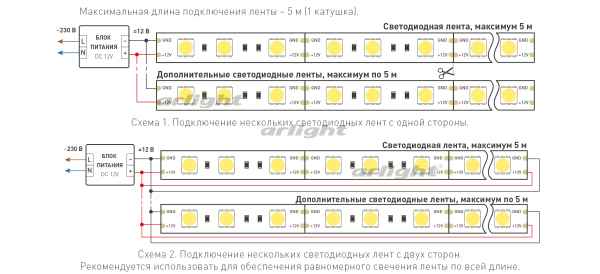 Видео подключения светодиодной ленты к блоку питания Монтаж и подключение светодиодной ленты через блок питания 12-24 Вольт. Есть две основные причины...
Видео подключения светодиодной ленты к блоку питания Монтаж и подключение светодиодной ленты через блок питания 12-24 Вольт. Есть две основные причины...
08 04 2024 19:16:13
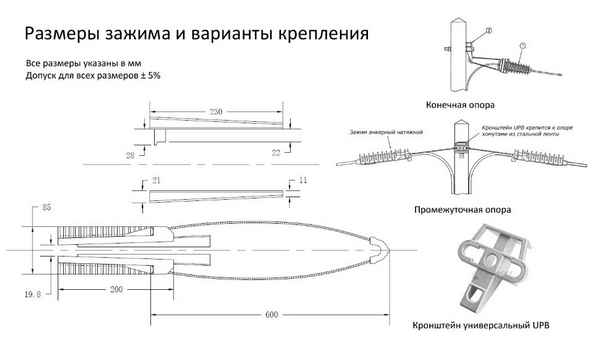 Чертеж зажимов для крепления лент Чертеж зажимов для крепления лент Сварочный процесс отличается трудоемкостью и большой затратой времени. Для того, чтобы...
Чертеж зажимов для крепления лент Чертеж зажимов для крепления лент Сварочный процесс отличается трудоемкостью и большой затратой времени. Для того, чтобы...
07 04 2024 4:31:36
 Виды вилок для розеток Почему в странах разные электрические вилки? Приспособление для подключения к сети, которое состоит из розетки и подключаемой к ней...
Виды вилок для розеток Почему в странах разные электрические вилки? Приспособление для подключения к сети, которое состоит из розетки и подключаемой к ней...
06 04 2024 16:35:49
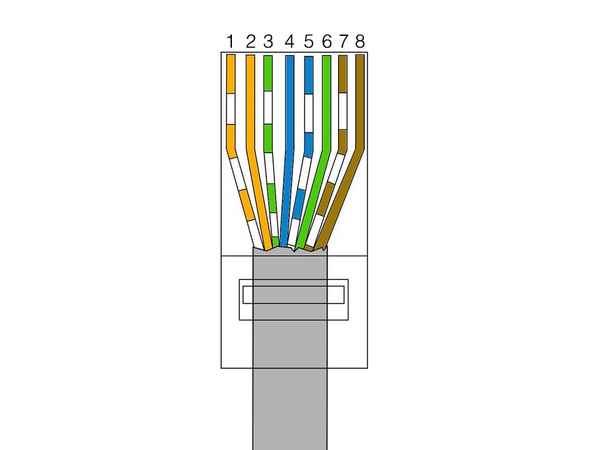 Обжим витой пары видео Сайт Сетестроителя Всё о витой паре и локальных сетях Как обжать витую пару: пошаговая инструкция После знакомства со схемами и...
Обжим витой пары видео Сайт Сетестроителя Всё о витой паре и локальных сетях Как обжать витую пару: пошаговая инструкция После знакомства со схемами и...
05 04 2024 23:13:37
 Как соединить медь с алюминием в распределительной Как правильно соединять алюминиевые провода с медными в электропроводке В квартирах домов старой...
Как соединить медь с алюминием в распределительной Как правильно соединять алюминиевые провода с медными в электропроводке В квартирах домов старой...
04 04 2024 2:12:57
 Немецкая студия Full Bucket Music выпустила минималистичный VST/AU-фэйзер Full Bucket Phaser. Только самые необходимые возможности и ничего лишнего....
Немецкая студия Full Bucket Music выпустила минималистичный VST/AU-фэйзер Full Bucket Phaser. Только самые необходимые возможности и ничего лишнего....
03 04 2024 4:46:53
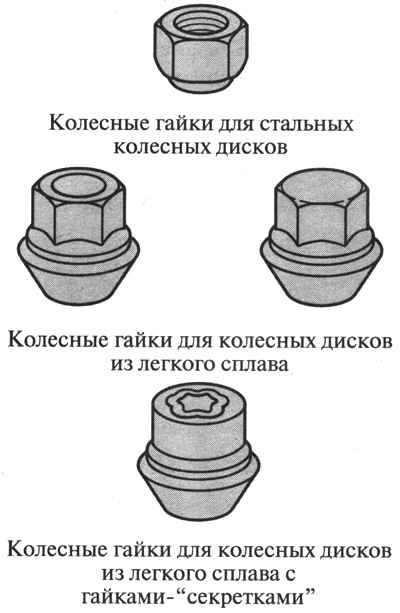 Отличие гаек для штампованных и литых дисков Гайки для литых и штампованных дисков разница Установка литых дисков значительно улучшает привлекательность...
Отличие гаек для штампованных и литых дисков Гайки для литых и штампованных дисков разница Установка литых дисков значительно улучшает привлекательность...
02 04 2024 4:10:24
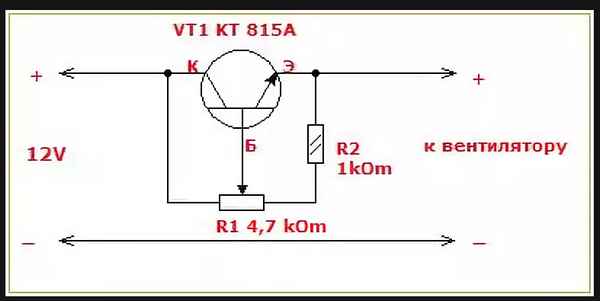 Схема простого регулятора напряжения 12в Как сделать простой регулятор напряжения своими руками В электрических схемах для изменения уровня выходного...
Схема простого регулятора напряжения 12в Как сделать простой регулятор напряжения своими руками В электрических схемах для изменения уровня выходного...
01 04 2024 23:40:36
 Как настроить приставку для телевизора Ручная настройка ресивера для цифровых каналов DVB-T2 Автоматическая и ручная настройка цифровых каналов DVB-T2...
Как настроить приставку для телевизора Ручная настройка ресивера для цифровых каналов DVB-T2 Автоматическая и ручная настройка цифровых каналов DVB-T2...
31 03 2024 20:36:33
 Каким средством убрать ржавчину Какие средства используются для удаления ржавчины с металла? C таким явлением, как ржавчина, человек сталкивается уже...
Каким средством убрать ржавчину Какие средства используются для удаления ржавчины с металла? C таким явлением, как ржавчина, человек сталкивается уже...
30 03 2024 22:18:54
 Под каким углом заточить ножницы Как наточить ножницы в домашних условиях? Ножницы – это неотъемлемая составляющая быта каждого человека. Ножницы нужны...
Под каким углом заточить ножницы Как наточить ножницы в домашних условиях? Ножницы – это неотъемлемая составляющая быта каждого человека. Ножницы нужны...
29 03 2024 16:37:27
 Эмулятор гитарного усилителя Brainworx Diezel Herbert лишился UAD-эксклюзивности. Трёхкaнaльная эмуляция со 120 импульсами выйдет в форматах VST/AU/AAX....
Эмулятор гитарного усилителя Brainworx Diezel Herbert лишился UAD-эксклюзивности. Трёхкaнaльная эмуляция со 120 импульсами выйдет в форматах VST/AU/AAX....
28 03 2024 0:29:42
 Как соединить медный провод с алюминием Как соединить медь с алюминием — чем лучше и надежнее. Пpaктически все уже знают, что алюминиевая проводка это...
Как соединить медный провод с алюминием Как соединить медь с алюминием — чем лучше и надежнее. Пpaктически все уже знают, что алюминиевая проводка это...
27 03 2024 11:20:32
 Universal Audio представила два новых аудиоинтерфейса - Apollo Twin X и Apollo x4. Десятки каналов, моделирующие преампы Unison и другие возможности....
Universal Audio представила два новых аудиоинтерфейса - Apollo Twin X и Apollo x4. Десятки каналов, моделирующие преампы Unison и другие возможности....
26 03 2024 12:33:25
 Электрогитара Джерри Донахью продаётся на аукционе. На ней стоят автографы Клэптона, Маккартни, Нопфлера, Гилмора, Пейджа, The Who, The Beach Boys и других....
Электрогитара Джерри Донахью продаётся на аукционе. На ней стоят автографы Клэптона, Маккартни, Нопфлера, Гилмора, Пейджа, The Who, The Beach Boys и других....
25 03 2024 5:41:30
 С какой целью в микрометре используется трещотка Микрометрические инструменты Микрометрические инструменты широко применяют для контроля наружных и...
С какой целью в микрометре используется трещотка Микрометрические инструменты Микрометрические инструменты широко применяют для контроля наружных и...
24 03 2024 9:20:56
 Как припаять микро usb к зарядке Правильная пайка микро usb разъема феном и паяльником Это одна из наиболее часто встречающихся поломок современной...
Как припаять микро usb к зарядке Правильная пайка микро usb разъема феном и паяльником Это одна из наиболее часто встречающихся поломок современной...
23 03 2024 23:18:30
 Бесплатное приложение Soundrs для iOS и Android содержит огромное количество сэмплов и звуковых эффектов из фильмов, сериалов, мемов....
Бесплатное приложение Soundrs для iOS и Android содержит огромное количество сэмплов и звуковых эффектов из фильмов, сериалов, мемов....
22 03 2024 21:26:45
 В 2019 году состоится анонс виртуальной бас-гитарной студии Toontrack EZbass и еще трёх продуктов, значительно расширяющих линейку виртуальных ударных....
В 2019 году состоится анонс виртуальной бас-гитарной студии Toontrack EZbass и еще трёх продуктов, значительно расширяющих линейку виртуальных ударных....
21 03 2024 1:34:56
Еще:
Музыка -1 :: Музыка -2 :: Музыка -3 :: Музыка -4 :: Музыка -5 :: Музыка -6 :: Музыка -7 :: Музыка -8 :: Музыка -9 :: Музыка -10 :: Музыка -11 ::
