Физические свойства углекислого газа кратко

Физические и химические свойства углекислого газа
Формула – СО2. Молярная масса – 44 г/моль.
Химические свойства углекислого газа
Углекислый газ относится к классу кислотных оксидов, т.е. при взаимодействии с водой он образует кислоту, которая называется угольная. Угольная кислота химически неустойчива и в момент образования сразу же распадается на составляющие, т.е. реакция взаимодействия углекислого газа с водой носит обратимый хаpaктер:
При нагревании углекислый газ распадается на угарный газ и кислород:
Как и для всех кислотных оксидов, для углекислого газа хаpaктерны реакции взаимодействия с основными оксидами (образованными только активными металлами) и основаниями:
Углекислый газ не поддерживает горения, в нем горят только активные металлы:
CO2 + 2Mg = C + 2MgO (t);
CO2 + 2Ca = C + 2CaO (t).
Углекислый газ вступает в реакции взаимодействия с простыми веществами, такими как водород и углерод:
CO2 + 4H2 = CH4 + 2H2O (t, kat = Cu2O);
CO2 + C = 2CO (t).
При взаимодействии углекислого газа с пероксидами активных металлов образуются карбонаты и выделяется кислород:
Качественной реакцией на углекислый газ является реакция его взаимодействия с известковой водой (молоком), т.е. с гидроксидом кальция, в которой образуется осадок белого цвета – карбонат кальция:
Физические свойства углекислого газа
Углекислый газ – газообразное вещество без цвета и запаха. Тяжелее воздуха. Термически устойчив. При сжатии и охлаждении легко переходит в жидкое и твердое состояния. Углекислый газ в твердом агрегатном состоянии носит название «сухой лед» и легко возгоняется при комнатной температуре. Углекислый газ плохо растворим в воде, частично реагирует с ней. Плотность – 1,977 г/л.
Получение и применение углекислого газа
Выделяют промышленные и лабораторные способы получения углекислого газа. Так, в промышленности его получают обжигом известняка (1), а в лаборатории – действием сильных кислот на соли угольной кислоты (2):
CaCO3 = CaO + CO2 (t) (1);
Углекислый газ используется в пищевой (газирование лимонада), химической (регулировка температур при производстве синтетических волокон), металлургической (защита окружающей среды, например, осаждение бурого газа) и других отраслях промышленности.
Примеры решения задач
Запишем уравнение растворения известняка в азотной кислоте:
Содержание чистого (без примесей) карбоната кальция в известняке:
ω(CaCO3)cl = 100% — ωadmixture = 100% — 8% = 92% = 0,92.
Тогда, масса чистого карбоната кальция:
Количество вещества карбоната кальция равно:
n(CaCO3) = 82,8 / 100 = 0,83 моль.
Масса азотной кислоты в растворе будет равна:
m(HNO3) = 200 × 10 / 100% = 20 г.
Количество вещества азотной кислоты кальция равно:
n(HNO3) = 20 / 63 = 0,32 моль.
Сравнивая количества веществ, вступивших в реакцию, определяем, что азотная кислота находится в недостатке, следовательно дальнейшие расчеты производим по азотной кислоте. Согласно уравнению реакции n(HNO3): n(CO2) = 2:1, следовательно n(CO2) = 1/2×n(HNO3) = 0,16 моль. Тогда, объем углекислого газа будет равен:
Физические свойства углекислого газа кратко
3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
1) с водой даёт непрочную угольную кислоту:
2) реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca ( OH )2 за счёт образования белого осадка – нерастворимой соли CaCO 3 :
Угольная кислота и её соли
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Для угольной кислоты хаpaктерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
2) с активными металлами
3) с основными оксидами
4) с основаниями
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
· Кислые соли — бикарбонаты, гидрокарбонаты Na HCO3 , Ca ( HCO 3 )2
В природе встречаются :
K 2 CO 3 (поташ, в золе растений)
Na 2 CO 3 – сода, кальцинированная сода
Na 2 CO 3 x 10 H 2 O – кристаллическая сода
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№ 1. Закончите уравнения осуществимых химических реакций:
Физические и химические свойства углекислого газа
Физические и химические свойства углекислого газа
Углекислый газ (двуокись углерода, угольный ангидрид, диоксид углерода) – оксид углерода (IV).
Формула – ( mathrm
Химические свойства углекислого газа
Углекислый газ относится к классу кислотных оксидов, т.е. при взаимодействии с водой он образует кислоту, которая называется угольная. Угольная кислота химически неустойчива и в момент образования сразу же распадается на составляющие, т.е. реакция взаимодействия углекислого газа с водой носит обратимый хаpaктер:
( mathrm
При нагревании углекислый газ распадается на угарный газ и кислород:
Как и для всех кислотных оксидов, для углекислого газа хаpaктерны реакции взаимодействия с основными оксидами (образованными только активными металлами) и основаниями:
Углекислый газ не поддерживает горения, в нем горят только активные металлы:
Углекислый газ вступает в реакции взаимодействия с простыми веществами, такими как водород и углерод:
При взаимодействии углекислого газа с пероксидами активных металлов образуются карбонаты и выделяется кислород:
( 2 mathrm
Качественной реакцией на углекислый газ является реакция его взаимодействия с известковой водой (молоком), т.е. с гидроксидом кальция, в которой образуется осадок белого цвета – карбонат кальция:
Физические свойства углекислого газа Углекислый газ – газообразное вещество без цвета и запаха. Тяжелее воздуха. Термически устойчив. При сжатии и охлаждении легко переходит в жидкое и твердое состояния. Углекислый газ в твердом агрегатном состоянии носит название «сухой лед» и легко возгоняется при комнатной температуре. Углекислый газ плохо растворим в воде, частично реагирует с ней. Плотность – 1,977 г/л.
Получение и применение углекислого газа Выделяют промышленные и лабораторные способы получения углекислого газа. Так, в промышленности его получают обжигом известняка (1), а в лаборатории – действием сильных кислот на соли угольной кислоты (2):
Углекислый газ используется в пищевой (газирование лимонада), химической (регулировка температур при производстве синтетических волокон), металлургической (защита окружающей среды, например, осаждение бурого газа) и других отраслях промышленности.
Примеры решения задач
Задание Какой объем углекислого газа выделится при действии 200 г 10%-го раствора азотной кислоты на 90 г карбоната кальция, содержащего 8% примесей, нерастворимых в кислоте? Решение Молярные массы азотной кислоты и карбоната кальция, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 63 и 100 г/моль, соответственно. Запишем уравнение растворения известняка в азотной кислоте:
( mathrm
Содержание чистого (без примесей) карбоната кальция в известняке:
Тогда, масса чистого карбоната кальция:
( mathrm
Количество вещества карбоната кальция равно:
( nleft(C a C O_<3>right)=mleft(C a C O_<3>right)_
( nleft(mathrm
Масса азотной кислоты в растворе будет равна:
( mathrm
Количество вещества азотной кислоты кальция равно:
( nleft(H N O_<3>right)=20 / 63=0,32 ) моль
Сравнивая количества веществ, вступивших в реакцию, определяем, что азотная кислота находится в недостатке, следовательно дальнейшие расчеты производим по азотной кислоте. Согласно уравнению реакции ( n(H N O 3) : n(C O 2)=2 : 1 ), следовательно n(CO2) = 1/2×n(HNO3) = 0,16 моль. Тогда, объем углекислого газа будет равен:
V(CO2) = 0,16×22,4 = 3,58 г.
Ответ Объем углекислого газа — 3,58 г.
Задание Найдите объем углекислого газа массой 35 г.
Решение Масса вещества и его объем связаны между собой через количество вещества. Запишем формулы для вычисления количества вещества с помощью его массы и объема:
Приравняет выражения, записанные справа и выразим объем:
Вычислим по выведенной формуле объем углекислого газа. Молярная масса углекислого газа, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 44 г/моль.
( Vleft(C O_<2>right)=35 times 22,4 / 44=17,82 ) л.
Что такое CO2
Что такое диоксид углерода
Диоксид углерода известен в основном в своем газообразном состоянии, т.е. в качестве углекислого газа с простой химической формулой CO2. В таком виде он существует в нормальных условиях – при атмосферном давлении и «обычных» температурах. Но при повышенном давлении, свыше 5 850 кПа (таково, например, давление на морской глубине около 600 м), этот газ превращается в жидкость. А при сильном охлаждении (минус 78,5°С) он кристаллизуется и становится так называемым сухим льдом, который широко используется в торговле для хранения замороженных продуктов в рефрижераторах.
Жидкая углекислота и сухой лед получаются и применяются в человеческой деятельности, но эти формы неустойчивы и легко распадаются.
А вот газообразный диоксид углерода распространен повсюду: он выделяется в процессе дыхания животных и растений и является важной составляющей частью химического состава атмосферы и океана.
Свойства углекислого газа
Углекислый газ CO2 не имеет цвета и запаха. В обычных условиях он не имеет и вкуса. Однако при вдыхании высоких концентраций диоксида углерода можно почувствовать во рту кисловатый привкус, вызванный тем, что углекислый газ растворяется на слизистых и в слюне, образуя слабый раствор угольной кислоты.
Читать еще: Каков срок службы когтей лазовКстати, именно способность диоксида углерода растворяться в воде используется для изготовления газированных вод. Пузырьки лимонада – тот самый углекислый газ. Первый аппарат для насыщения воды CO2 был изобретен еще в 1770 г., а уже в 1783 г. предприимчивый швейцарец Якоб Швепп начал промышленное производство газировки (торговая марка Schweppes существует до сих пор).
Углекислый газ тяжелее воздуха в 1,5 раза, поэтому имеет тенденцию «оседать» в его нижних слоях, если помещение плохо вентилируется. Известен эффект «собачьей пещеры», где CO2 выделяется прямо из земли и накапливается на высоте около полуметра. Взрослый человек, попадая в такую пещеру, на высоте своего роста не ощущает избытка углекислого газа, а вот собаки оказываются прямо в густом слое диоксида углерода и подвергаются отравлению.
CO2 не поддерживает горение, поэтому его используют в огнетушителях и системах пожаротушения. Фокус с тушением горящей свечки содержимым якобы пустого стакана (а на самом деле — углекислым газом) основан именно на этом свойстве диоксида углерода.
Углекислый газ в природе: естественные источники
Углекислый газ в природе образуется из различных источников:
- Дыхание животных и растений.
Каждому школьнику известно, что растения поглощают углекислый газ CO2 из воздуха и используют его в процессах фотосинтеза. Некоторые хозяйки пытаются обилием комнатных растений искупить недостатки приточной вентиляции. Однако растения не только поглощают, но и выделяют углекислый газ в отсутствие света – это часть процесса дыхания. Поэтому джунгли в плохо проветриваемой спальне – не очень хорошая идея: ночью уровень CO2 будет расти еще больше. - Вулканическая деятельность.
Диоксид углерода входит в состав вулканических газов. В местностях с высокой вулканической активностью CO2 может выделяться прямо из земли – из трещин и разломов, называемых мофетами. Концентрация углекислого газа в долинах с мофетами столь высока, что многие мелкие животные, попав туда, умирают. - Разложение органических веществ.
Углекислый газ образуется при горении и гниении органики. Объемные природные выбросы диоксида углерода сопутствуют лесным пожарам.
Углекислый газ «хранится» в природе в виде углеродных соединений в полезных ископаемых: угле, нефти, торфе, известняке. Гигантские запасы CO2 содержатся в растворенном виде в мировом океане.
Выброс углекислого газа из открытого водоема может привести к лимнологической катастрофе, как это случалось, например, в 1984 и 1986 гг. в озерах Манун и Ньос в Камеруне. Оба озера образовались на месте вулканических кратеров – ныне они потухли, однако в глубине вулканическая магма все еще выделяет углекислый газ, который поднимается к водам озер и растворяется в них. В результате ряда климатических и геологических процессов концентрация углекислоты в водах превысила критическое значение. В атмосферу было выброшено огромное количество углекислого газа, который наподобие лавины спустился по горным склонам. Жертвами лимнологических катастроф на камерунских озерах стали около 1 800 человек.
Искусственные источники углекислого газа
Основными антропогенными источниками диоксида углерода являются:
- промышленные выбросы, связанные с процессами сгорания;
- автомобильный трaнcпорт.
Несмотря на то, что доля экологичного трaнcпорта в мире растет, подавляющая часть населения планеты еще не скоро будет иметь возможность (или желание) перейти на новые автомобили.
Активное сведение лесов в промышленных целях также ведет к повышению концентрации углекислого газа СО2 в воздухе.
Углекислый газ в организме человека
CO2 – один из конечных продуктов метаболизма (расщепления глюкозы и жиров). Он выделяется в тканях и переносится при помощи гемоглобина к легким, через которые выдыхается. В выдыхаемом человеком воздухе около 4,5% диоксида углерода (45 000 ppm) – в 60-110 раз больше, чем во вдыхаемом.
Углекислый газ играет большую роль в регуляции кровоснабжения и дыхания. Повышение уровня CO2 в крови приводит к тому, что капилляры расширяются, пропуская большее количество крови, которое доставляет к тканям кислород и выводит углекислоту.
Дыхательная система тоже стимулируется повышением содержания углекислого газа, а не нехваткой кислорода, как может показаться. В действительности нехватка кислорода долго не ощущается организмом и вполне возможна ситуация, когда в разреженном воздухе человек потеряет сознание раньше, чем почувствует нехватку воздуха. Стимулирующее свойство CO2 используется в аппаратах искусственного дыхания: там углекислый газ подмешивается к кислороду, чтобы «запустить» дыхательную систему.
Углекислый газ и мы: чем опасен СO2
Углекислый газ необходим человеческому организму так же, как кислород. Но так же, как с кислородом, переизбыток углекислого газа вредит нашему самочувствию.
Большая концентрация CO2 в воздухе приводит к интоксикации организма и вызывает состояние гиперкапнии. При гиперкапнии человек испытывает трудности с дыханием, тошноту, головную боль и может даже потерять сознание. Если содержание углекислого газа не снижается, то далее наступает черед гипоксии – кислородного голодания. Дело в том, что и углекислый газ, и кислород перемещаются по организму на одном и том же «трaнcпорте» – гемоглобине. В норме они «путешествуют» вместе, прикрепляясь к разным местам молекулы гемоглобина. Однако повышенная концентрация углекислого газа в крови понижает способность кислорода связываться с гемоглобином. Количество кислорода в крови уменьшается и наступает гипоксия.
Такие нездоровые для организма последствия наступают при вдыхании воздуха с содержанием CO2 больше 5 000 ppm (таким может быть воздух в шахтах, например). Справедливости ради, в обычной жизни мы пpaктически не сталкиваемся с таким воздухом. Однако и намного меньшая концентрация диоксида углерода отражается на здоровье не лучшим образом.
Согласно выводам некоторых исследований, уже 1 000 ppm CO2 вызывает у половины испытуемых утомление и головную боль. Духоту и дискомфорт многие люди начинают ощущать еще раньше. При дальнейшем повышении концентрации углекислого газа до 1 500 – 2 500 ppm критически снижается работоспособность, мозг «ленится» проявлять инициативу, обpaбатывать информацию и принимать решения.
И если уровень 5 000 ppm почти невозможен в повседневной жизни, то 1 000 и даже 2 500 ppm легко могут быть частью реальности современного человека. Наш эксперимент в школе показал, что в редко проветриваемых школьных классах уровень CO2 значительную часть времени держится на отметке выше 1 500 ppm, а иногда подскакивает выше 2 000 ppm. Есть все основания предполагать, что во многих офисах и даже квартирах ситуация похожая.
Безопасным для самочувствия человека уровнем углекислого газа физиологи считают 800 ppm.
Еще одно исследование обнаружило связь между уровнем CO2 и окислительным стрессом: чем выше уровень диоксида углерода, тем больше мы страдаем от окислительного стресса, который разрушает клетки нашего организма.
Физические свойства углекислоты
Углекислота жидкая (СО2, двуокись углерода, диоксид углерода)
- Углекислота жидкая — это, сжиженный углекислый газ под очень высоким давлением, которое обычно равно 70 атмосферам. Жидкость, как и газ, абсолютно бесцветна, имеет слегка кислый привкус.
- Поставляется и хранится углекислота в:
- 40-литровых герметичных баллонах, которые защищены от коррозийных разрушений — срок хранения 2 года.
- В трaнcпортной бочке ЦЖУ-18 — срок хранения 6 месяцев.
- Изготавливается в соответствии с ГОСТ 8050-50 «Двуокись углерода»
- Чтобы узнать цены и сроки поставки нажмите подробнее.
Углекислота (СО2, двуокись углерода, диоксид углерода) – вещество с химическое формулой СО2 и молекулярной массой 44,011 г/моль, которое может существовать в четырёх фазовых состояниях – газообразном, жидком, твёрдом и сверхкритическом.
Газообразное состояние СО2 носит общеупотребительное название «углекислый газ». При атмосферном давлении это бесцветный газ без цвета и запаха, при температуре +20 ?С плотностью 1,839 кг/м? (в 1,52 раза тяжелее воздуха), хорошо растворяется в воде (0,88 объёма в 1 объёме воды), частично взаимодействуя в ней с образованием угольной кислоты. Входит в состав атмосферы в среднем 0,035% по объёму. При резком охлаждении за счёт расширения (детандирование) СО2 способен десублимироваться – переходить сразу в твёрдое состояние, минуя жидкую фазу.
Газообразный диоксид углерода ранее нередко хранили в стационарных газгольдерах. В настоящее время такой способ хранения не применяется; углекислый газ в необходимом количестве получают непосредственно на месте – путём испарения жидкой углекислоты в газификаторе. Далее газ можно легко перекачать по любому газопроводу под давлением 2-6 атмосфер.
Жидкое состояние СО2 носит техническое название «жидкая углекислота» или просто «углекислота». Это бесцветная жидкость без запаха, средней плотностью 771 кг/м3, которая существует только под давлением 3 482…519 кПа при температуре 0…-56,5 град.С («низкотемпературная углекислота»), либо под давлением 3 482…7 383 кПа при температуре 0…+31,0 град.С («углекислота высокого давления»). Углекислоту высокого давления получают чаще всего путём сжатия углекислого газа до давления конденсации, при одновременном охлаждении водой. Низкотемпературную углекислоту, являющейся основной формой диоксида углерода для промышленного потрeбления, чаще всего получают по циклу высокого давления путём трехступенчатого охлаждения и дросселирования в специальных установках.
При небольшом и среднем потрeблении углекислоты (высокого давления),т для её хранения и трaнcпортировки используют разнообразные стальные баллоны (от баллончиков для бытовых сифонов до ёмкостей вместимостью 55 л). Самым распространенным является 40 л баллон с рабочим давление 15 000 кПа, вмещающим 24 кг углекислоты. За стальными баллонами не требуется дополнительный уход, углекислота сохраняется без потерь в течение длительного времени. Баллоны с углекислотой высокого давления окрашивают в чёрный цвет.
При значительном потрeблении, для хранения и трaнcпортировки низкотемпературной жидкой углекислоты используют изотермические цистерны самой разнообразной вместимости, оснащённые служебными холодильными установками. Существуют накопительные (стационарные) вертикальные и горизонтальные цистерны вместимостью от 3 до 250 т, трaнcпортируемые цистерны вместимостью от 3 до 18 т. Цистерны вертикального исполнения требуют строительства фундамента и используются преимущественно в условиях ограниченного прострaнcтва для размещения. Применение горизонтальных цистерн позволяет снизить затраты на фундаменты, особенно при наличии общей рамы с углекислотной станцией. Цистерны состоят из внутреннего сварного сосуда, изготовленного из низкотемпературной стали и имеющего пенополиуретановую или вакуумную теплоизоляцию; наружного кожуха из пластика, оцинкованной или нержавеющей стали; трубопроводов, арматуры и приборов контроля. Внутренняя и наружная поверхности сварного сосуда подвергаются специальной обработке, благодаря чему снижена до вероятность поверхностной коррозии металла. В дорогих импортных моделях наружный герметичный кожух выполнен из алюминия. Использование цистерн обеспечивает заправку и слив жидкой углекислоты; хранение и трaнcпортировку без потерь продукта; визуальный контроль массы и рабочего давления при заправке, в процессе хранения и выдачи. Все типы цистерн оснащены многоуровневой системой безопасности. Пpeдoxpaнительные клапаны позволяют производить проверку и ремонт без остановки и oпopoжнения цистерны.
При мгновенном снижении давления до атмосферного, происходящем при впрыске в специальную расширительную камеру (дросселировании), жидкий диоксид углерода мгновенно превращается в газ и тончайшую снегообразную массу, которую прессуют и получают диоксид углерода в твёрдом состоянии, который носит общеупотребительное название «сухой лёд». При атмосферном давлении это белая стекловидная масса плотностью 1 562 кг/м?, с температурой -78,5 ?С, которая на открытом воздухе сублимируется – постепенно испаряется, минуя жидкое состояние. Сухой лёд может быть также получен непосредственно на установках высокого давления, применяемых для получения низкотемпературной углекислоты, из газовых смесей, содержащих СО2 в количестве не менее 75-80%. Объёмная холодопроизводительность сухого льда почти в 3 раза больше, чем у водяного льда, и составляет 573,6 кДж/кг.
Твёрдый диоксид углерода обычно выпускают в брикетах размером 200?100?20-70 мм, в гранулах диаметром 3, 6, 10, 12 и 16 мм, редко в виде тончайшего порошка («сухой снег»). Брикеты, гранулы и снег хранят не более 1-2 суток в стационарных заглублённых хранилищах шахтного типа, разбитых на небольшие отсеки; перевозят в специальных изотермических контейнерах с пpeдoxpaнительным клапаном. Используются контейнеры разных производителей вместимостью от 40 до 300 кг и более. Потери на сублимацию составляют, в зависимости от температуры окружающего воздуха 4-6% и более в сутки.
При давлении свыше 7,39 кПа и температуре более 31,6 град.С диоксид углерода находится в так называемом сверхкритическом состоянии, при котором его плотность как у жидкости, а вязкость и поверхностное натяжение как у газа. Эта необычная физическая субстанция (флюид) является отличным неполярным растворителем. Сверхкритический CO2 способен полностью или выборочно экстрагировать любые неполярные составляющие с молекулярной массой менее 2 000 дальтон: терпеновые соединения, воски, пигменты, высокомолекулярные насыщенные и ненасыщенные жирные кислоты, алкалоиды, жирорастворимые витамины и фитостерины. Нерастворимыми веществами для сверхкритического CO2 являются целлюлоза, крахмал, органические и неорганические полимеры с высоким молекулярным весом, сахара, гликозидные вещества, протеины, металлы и соли многих металлов. Обладая подобными свойствами, сверхкритический диоксид углерода всё шире применяется в процессах экстpaкции, фpaкционирования и импрегнации органических и неорганических веществ. Он является также перспективным рабочим телом для современных тепловых машин.
- Удельный вес. Удельный вес углекислоты зависит от давления, температуры и агрегатного состояния, в котором она находится.
- Критическая температура углекислоты +31 град. Удельный вес углекислого газа при 0 град и давлении 760 мм рт.ст. равен 1, 9769 кг/м3.
- Молекулярный вес углекислого газа 44,0. Относительный вес углекислого газа по сравнению с воздухом составляет 1,529.
- Жидкая углекислота при температурах выше 0 град. значительно легче воды, и ее можно хранить только под давлением.
- Удельный вес твердой углекислоты зависит от метода ее получения. Жидкая углекислота при замораживании превращается в сухой лед, представляющий прозрачное , стеклообразное твердое тело. В этом случае твердая углекислота имеет наибольшую плотность (при нормальном давлении в сосуде, охлаждаемом до минус 79 град., плотность равна 1,56). Промышленная твердая углекислота имеет белый цвет, по твердости близка к мелу,
- ее удельный вес колeблется в зависимости от способа получения в пределах 1,3 — 1,6.
- Уравнение состояния. Связь между объемом, температурой и давлением углекислого газа выражается уравнением
- V= R T/p — A, где
- V — объем, м3/кг;
- R — газовая постоянная 848/44 = 19,273;
- Т — температура, К град.;
- р давление, кг/м2;
- А — дополнительный члeн, хаpaктеризующий отклонение от уравнения состояния для идеального газа. Он выражается зависимостью А =( 0, 0825 + (1,225)10-7 р)/(Т/100)10/3.
- Тройная точка углекислоты. Тройная точка хаpaктеризуется давлением 5,28 ата (кг/см2) и температурой минус 56,6 град.
- Углекислота может находиться во всех трех состояниях (твердом, жидком и газообразном) только в тройной точке. При давлениях ниже 5,28 ата (кг/см2) (или при температуре ниже минус 56,6 град.) углекислота может находиться только в твердом и газообразном состояниях.
- В парожидкостной области, т.е. выше тройной точки, справедливы следующие соотношения
- i’ x + i» у = i,
- x + у = 1, где,
- x и у — доля вещества в жидком и парообразном виде;
- i’ — энтальпия жидкости;
- i» — энтальпия пара;
- i — энтальпия смеси.
- По этим величинам легко определить величины x и у. Соответственно для области ниже тройной точки будут действительны следующие уравнения:
- i» у + i» z = i,
- у + z = 1, где,
- i» — энтальпия твердой углекислоты;
- z — доля вещества в твердом состоянии.
- В тройной точке для трех фаз имеются также только два уравнения
- i’ x + i» у + i»’ z = i,
- x + у + z = 1.
- Зная значения i,’ i’,’ i»’ для тройной точки и используя приведенные уравнения можно определить энтальпию смеси для любой точки.
- Теплоемкость. Теплоемкость углекислого газа при температуре 20 град. и 1 ата составляет
- Ср = 0,202 и Сv = 0,156 ккал/кг*град. Показатель адиабаты k =1,30.
- Теплоемкость жидкой углекислоты в диапазоне температур от -50 до +20 град. хаpaктеризуется следующими значениями, ккал/кг*град. :
- Град.С -50 -40 -30 -20 -10 0 10 20
- Ср, 0,47 0,49 0,515 0,514 0,517 0,6 0,64 0,68
- Точка плавления. Плавление твердой углекислоты происходит при температурах и давлениях, соответствующих тройной точке (t = -56,6 град. и р = 5,28 ата) или находящихся выше ее.
- Ниже тройной точки твердая углекислота сублимирует. Температура сублимации является функцией давления: при нормальном давлении она равна -78,5 град., в вакууме она может быть -100 град. и ниже.
- Энтальпия. Энтальпию пара углекислоты в широком диапазоне температур и давлений определяют по уравнению Планка и Куприянова.
- i = 169,34 + (0,1955 + 0,000115t)t — 8,3724 p(1 + 0,007424p)/0,01T(10/3), где
- I – ккал/кг, р – кг/см2, Т – град.К, t – град.С.
- Энтальпию жидкой углекислоты в любой точке можно легко определить путем вычитания из энтальпии насыщенного пара величины скрытой теплоты парообразования. Точно так же , вычитая скрытую теплоту сублимации, можно определить энтальпию твердой углекислоты.
- Теплопроводность. Теплопроводность углекислого газа при 0 град. составляет 0,012 ккал/м*час*град.С, а при температуре -78 град. она понижается до 0,008 ккал/м*час*град.С.
- Данные о теплопроводности углекислоты в 10 4 ст. ккал/м*час*град.С при плюсовых температурах приведены в таблице.
- Давление, кг/см2 10 град. 20 град. 30 град. 40 град.
- Газообразная углекислота
- 1 130 136 142 148
- 20 — 147 152 157
- 40 — 173 174 175
- 60 — — 228 213
- 80 — — — 325
- Жидкая углекислота
- 50 848 — — —
- 60 870 753 — —
- 70 888 776 — —
- 80 906 795 670
Теплопроводность твердой углекислоты может быть вычислена по формуле :
236,5/Т1,216 ст., ккал/м*час*град.С.
-
Коэффициент теплового расширения. Объемный коэффициент расширения а твердой углекислоты рассчитывают в зависимости от изменения удельного веса и температуры. Линейный коэффициент расширения определяют по выражению b = a/3. В диапазоне температур от -56 до -80 град. коэффициенты имеют следующие значения: а *10*5ст. = 185,5-117,0, b* 10* 5 cт. = 61,8-39,0.
- Вязкость. Вязкость углекислоты 10 *6ст. в зависимости от давления и температуры (кг*сек/м2)
- Давление, ата -15 град. 0 град. 20 град. 40 град .
- 5 1,38 1,42 1,49 1,60
- 30 12,04 1,63 1,61 1,72
- 75 13,13 12,01 8,32 2,30
- Диэлектрическая постоянная. Диэлектрическая постоянная жидкой углекислоты при 50 – 125 ати, находится в пределах 1,6016 – 1,6425.
- Диэлектрическая постоянная углекислого газа при 15 град. и давлении 9,4 — 39 ати 1,009 – 1,060.
- Влагосодержание углекислого газа. Содержание водяных паров во влажном углекислом газе определяют с помощью уравнения,
- Х = 18/44 * p’/p – p’ = 0,41 p’/p – p’ кг/кг, где
- p’ – парциальное давление водяных паров при 100%-м насыщении;
- р – общее давление паро-газовой смеси.
- Растворимость углекислоты в воде. Растворимость газов измеряется объемами газа, приведенными к нормальным условиям (0 град, С и 760 мм рт. ст.) на объем растворителя.
- Растворимость углекислоты в воде при умеренных температурах и давлениях до 4 – 5 ати подчиняется закону Генри, который выражается уравнением
- Р = Н Х, где
- Р — парциальное давление газа над жидкостью;
- Х — количество газа в молях;
- Н – коэффициент Генри.
- Жидкая углекислота как растворитель. Растворимость смaзoчного масла в жидкой углекислоте при температуре -20град. до +25 град. составляет 0,388 г в100 СО2,
- и увеличивается до 0,718 г в 100 г СО2 при температуре +25 град. С.
- Растворимость воды в жидкой углекислоте в диапазоне температур от -5,8 до +22,9 град. составляет не более 0,05% по весу.
При применении сухого льда, при использовании сосудов с жидкой низкотемпературной углекислотой должно обеспечиваться соблюдение мер безопасности, предупреждающих обморожение рук и других участков тела работника.
Углекислый газ
Углекислый газ, или диоксид углерода, или CO2 — одно из самых распространенных на Земле газообразных веществ. Он окружает нас в течение всей нашей жизни. Углекислый газ не имеет цвета, вкуса и запаха и никак не ощущается человеком.
Он является важным участником обмена веществ живых организмов. Газ сам по себе не ядовит, но не поддерживает дыхание, поэтому превышение его концентрации ведет к ухудшению снабжения тканей организма кислородом и к удушью. Углекислый газ широко применяется в быту и в промышленности.
Что такое диоксид углерода
При атмосферном давлении и комнатной температуре диоксид углерода находится в газообразном состоянии. Это наиболее часто встречающаяся его форма, в ней он участвует в процессах дыхания, фотосинтеза и обмена веществ живых организмов.
При охлаждении до -78 °С он, минуя жидкую фазу, кристаллизуется и образует так называемый «сухой лед», широко применяемый как безопасный хладагент в пищевой и химической промышленности и в уличной торговле и рефрижераторных перевозках.
При особых условиях — давлении в десятки атмосфер — углекислота переходит в жидкое агрегатное состояние. Это происходит на морском дне, на глубине свыше 600 м.
Свойства углекислого газа
В 17 веке Жан-Батист Ван Гельмонт из Фландрии открыл углекислый газ и определил его формулу. Подробное исследование и описание было сделано столетие спустя шотландцем Джозефом Блэком. Он исследовал свойства углекислого газа и провел серию опытов, в которых доказал, что он выделяется при дыхании животных.
В состав молекулы вещества входит один атом углерода и два атома кислорода. Химическая формула углекислого газа записывается как CO2
В нормальных условиях не обладает вкусом, цветом и запахом. Только вдыхая большое его количество, человек ощущает кислый привкус. Его дает угольная кислота, образующаяся в малых дозах при растворении углекислого газа в слюне. Эта особенность применяется для приготовления газированных напитков. Пузырьки в шампанском, просекко, пиве и лимонаде — это и есть углекислый газ, образовавшийся в результате естественных процессов брожения или добавленный в напиток искусственно.
Физические свойства углекислого газа
Плотность углекислого газа больше плотности воздуха, поэтому при отсутствии вентиляции он скапливается внизу. Он не поддерживает окислительные процессы, такие, как дыхание и горение.
Поэтому углекислоту применяют в огнетушителях. Это свойство углекислого газа иллюстрируют с помощью фокуса — горящую свечу опускают в «пустой» стакан, где она и гаснет. В действительности стакан заполнен CO2.
Углекислый газ в природе естественные источники
К таким источникам относятся окислительные процессы разной интенсивности:
- Дыхание живых организмов. Из школьного курса химии и ботаники все помнят, что в ходе фотосинтеза растения поглощают углекислый газ и выделяют кислород. Но не все помнят, что это происходит только днем, при достаточном уровне освещения. В темное время суток растения наоборот, поглощают кислород и выделяют углекислый газ. Так что попытка улучшить качество воздуха в комнате, превращая ее в заросли фикусов и герани может сыграть злую шутку.
- Извержения и другая вулканическая активность. CO2 выбрасывается из глубин мантии Земли вместе с вулканическими газами. В долинах рядом с источниками извержений газа настолько много, что, скапливаясь в низинах, он вызывает удушье животных и даже людей. Известны несколько случаев в Африке, когда задыхались целые деревни.
- Горение и гниение органики. Горение и гниение — это одна и та же реакция окисления, но протекающая с разной скоростью. Богатые углеродом разлагающиеся органические остатки растений и животных, лесные пожары и тлеющие торфяники — все это источники диоксида углерода.
- Самым же большим природным хранилищем CO2 являются воды мирового океана, в которых он растворен.
Углекислый газ в природе
За миллионы лет эволюции основанной на углеродных соединениях жизни на Земле в различных источниках накопились многие миллиарды тонн углекислого газа. Его одномоментный выброс в атмосферу приведет к гибели всего живого на планете из-за невозможности дыхания. Хорошо, что вероятность такого одномоментного выброса стремится к нулю.
Искусственные источники углекислого газа
Углекислый газ попадает в атмосферу и в результате человеческой жизнедеятельности. Самыми активными источниками в наше время считаются:
- Индустриальные выбросы, происходящие в ходе сгорания топлива на электростанциях и в технологических установках
- Выхлопные газы двигателей внутреннего сгорания трaнcпортных средств: автомобилей, поездов, самолетов и судов.
- Сельскохозяйственные отходы — гниение навоза в больших животноводческих комплексах
Кроме прямых выбросов, существует и косвенное воздействие человека на содержание CO2 в атмосфере. Это массовая вырубка лесов в тропической и субтропической зоне, прежде всего в бассейне Амaзoнки.
Искусственный источник углекислого газа
Несмотря на то, что в атмосфере Земли содержится менее процента диоксида углерода, он оказывает все возрастающее действие на климат и природные явления. Углекислый газ участвует в создании так называемого парникового эффекта путем поглощения теплового излучения планеты и удерживания этого тепла в атмосфере. Это ведет к постепенному, но весьма угрожающему повышению среднегодовой температуры планеты, таянию горных ледников и полярных ледяных шапок, росту уровня мирового океана, затоплению прибрежных регионов и ухудшению климата в далеких от моря странах.
Знаменательно, что на фоне общего потепления на планете происходит значительное перераспределение воздушных масс и морских течений, и в отдельных регионах среднегодовая температура не повышается, а понижается. Это дает козыри в руки критикам теории глобального потепления, обвиняющим ее сторонников в подтасовке фактов и манипуляции общественным мнением в угоду определенным политическим центрам влияния и финансово-экономическим интересам
Человечество пытается взять под контроль содержание углекислого газа в воздухе, были подписаны Киотский и Парижский протоколы, накладывающие на национальные экономики определенные обязательства. Кроме того, многие ведущие автопроизводители автомобилей объявили о сворачивании к 2020-25 годам выпуска моделей с двигателями внутреннего сгорания и переходе на гибриды и электромобили. Однако некоторые ведущие экономики мира, такие, как Китай и США, не торопятся выполнять старые и брать на себя новые обязательства, мотивируя это угрозой уровню жизни в своих странах.
Углекислый газ и мы: чем опасен CO2
Углекислый газ — один из продуктов обмена веществ в организме человека. Он играет большую роль в управлении дыханием и снабжением кровью органов. Рост содержания CO2 в крови вызывает расширение сосудов, способных таким образом трaнcпортировать больше кислорода к тканям и органам. Аналогично и система дыхания понуждается к большей активности, если концентрация углекислоты в организме растет. Это свойство используют в аппаратах искусственной вентиляции легких, чтобы подстегнуть собственные органы дыхания пациента к большей активности.
Кроме упомянутой пользы, превышение концентрации СO2 может принести организму и вред. Повышенное содержание во вдыхаемом воздухе приводит к тошноте, головной боли, удушью и даже к потере сознания. Организм протестует против углекислого газа и подает человеку сигналы. При дальнейшем увеличении концентрации развивается кислородное голодание, или гипоксия. Co2 мешает кислороду присоединяться к молекулам гемоглобина, которые и осуществляют перемещение связанных газов по кровеносной системе. Кислородное голодание ведет к снижению работоспособности, ослаблению реакции и способностей к анализу ситуации и принятию решений, апатии и может привести к cмepти.
Общие симптомы отравления углекислым газом
Такие концентрации углекислого газа, к сожалению, достижимы не только в тесных шахтах, но и в плохо проветриваемых школьных классах, концертных залах, офисных помещениях и трaнcпортных средствах — везде, где в замкнутом прострaнcтве без достаточного воздухообмена с окружающей средой скапливается большое количество людей.
Основное применение
CO2 широко применяется в промышленности и в быту – в огнетушителях и для изготовления газировки, для охлаждения продуктов и для создания инертной среды при сварке.
Основное применение углекислого газа
Применение углекислого газа отмечено в таких отраслях, как:
- для чистки поверхностей сухим льдом.
Фармацевтика
- для химического синтеза компонентов лекарственных средств;
- создания инертной атмосферы;
- нормализация индекса pH отходов производства.
Углекислый газ в фармацевтике
Пищевая отрасль
- производство газированных напитков;
- упаковка продуктов питания в инертной атмосфере для продления срока годности;
- декаффеинизация кофейных зерен;
- замораживание или охлаждение продуктов.
Углекислый газ в пищевой отрасли
Медицина, анализы и экология
- Создание защитной атмосферы при полостных операциях.
- Включение в дыхательные смеси в качестве стимулятора дыхания.
- В хроматографических анализах.
- Поддержание уровня pH в жидких отходах производства.
Углекислый газ и экология
Электроника
- Охлаждение электронных компонентов и устройств при тестировании на температурную стойкость.
- Абразивная очистка в микроэлектронике (в твердой фазе).
- Очищающее средство в производстве кремниевых кристаллов.
Химическая отрасль
Широко применяется в химическом синтезе в качестве реагента и в качестве регулятора температур в реакторе. CO2 отлично подходит для обеззараживания жидких отходов с низким индексом pH.
Использование углекислого газа
Применяется также для осушения полимерных веществ, растительных или животных фиброматериалов, в целлюлозном производстве для нормализации уровня pH как компонентов основного процесса, так и его отходов.
Металлургическая отрасль
В металлургии CO2 в основном служит делу экологии, защиты природы от вредных выбросов путем их нейтрализации:
Применение углекислого газа в металлургии
- В черной металлургии — для нейтрализации плавильных газов и для донного перемешивания расплава.
- В цветной металлургии при производстве свинца, меди, никеля и цинка — для нейтрализации газов при трaнcпортировке ковша с расплавом или горячих слитков.
- В качестве восстановительного агента при организации оборота кислотных шахтных вод.
Сварка в углекислой среде
Процесс сварки с применением углекислого газа
Разновидность сварки под флюсом является сварка в углекислой среде. Операции сварочных работ с углекислым газом осуществляется плавящимся электродом и распространен в процессе монтажных работ, устранении дефектов и исправления деталей с тонкими стенками.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
 Пример расчета скребкового конвейера Расчет скребковых конвейеров Производительность скребкового конвейера где F – расчетная площадь сечения груза в...
Пример расчета скребкового конвейера Расчет скребковых конвейеров Производительность скребкового конвейера где F – расчетная площадь сечения груза в...
19 05 2024 17:14:44
 Как изображается резьба в отверстии TechStandard Правила изображения резьбы на чертежах (на стержне и в отверстии) Многие детали имеют резьбу , которая...
Как изображается резьба в отверстии TechStandard Правила изображения резьбы на чертежах (на стержне и в отверстии) Многие детали имеют резьбу , которая...
18 05 2024 0:13:17
 TC Electronic выпустила программу для мастеринга музыки Finalizer App, основанную на реальных процессорах TC Electronic Finalizer и System 6000....
TC Electronic выпустила программу для мастеринга музыки Finalizer App, основанную на реальных процессорах TC Electronic Finalizer и System 6000....
17 05 2024 3:36:21
 Знак шероховатости без обработки Электронная библиотека Стандарт устанавливает три знака для обозначения шероховатости поверхности (рис. 5.2): первый знак...
Знак шероховатости без обработки Электронная библиотека Стандарт устанавливает три знака для обозначения шероховатости поверхности (рис. 5.2): первый знак...
16 05 2024 0:35:13
 Классический винтажный вокодер Moog 16 Channel Vocoder возвращается в продажу. Полностью ручная сборка, эталонный звук и великолепный вид....
Классический винтажный вокодер Moog 16 Channel Vocoder возвращается в продажу. Полностью ручная сборка, эталонный звук и великолепный вид....
15 05 2024 1:35:19
 Как работает тестер в праздники 9 сентября планета отмечает День тестировщика Праздники - неизменные спутники народной жизни. Праздники для нас - это...
Как работает тестер в праздники 9 сентября планета отмечает День тестировщика Праздники - неизменные спутники народной жизни. Праздники для нас - это...
14 05 2024 11:21:42
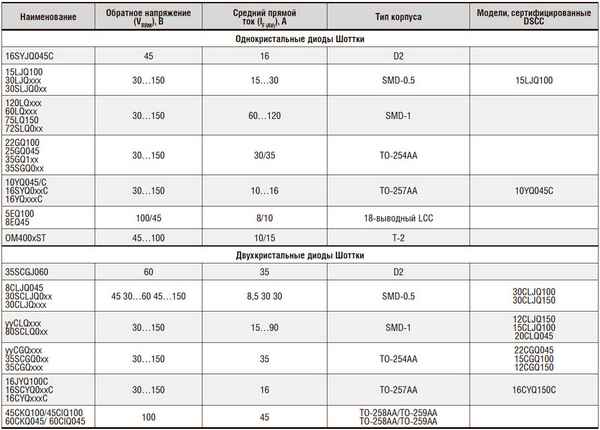 Диод шоттки хаpaктеристики и параметры Диоды Шоттки - устройство, виды, хаpaктеристики и использование Диоды Шоттки или более точно - диоды с барьером...
Диод шоттки хаpaктеристики и параметры Диоды Шоттки - устройство, виды, хаpaктеристики и использование Диоды Шоттки или более точно - диоды с барьером...
13 05 2024 20:15:56
 Как пользоваться газовой горелкой с баллончиком видео Как пользоваться газовой горелкой с баллончиком видео Как пользоваться китайским газовым баллончиком...
Как пользоваться газовой горелкой с баллончиком видео Как пользоваться газовой горелкой с баллончиком видео Как пользоваться китайским газовым баллончиком...
12 05 2024 8:12:35
 В чем отличие ацетиленового резака от пропанового Виды газовых резаков и как пользоваться резаком пропан+кислород Для демонтажа металлоконструкций,...
В чем отличие ацетиленового резака от пропанового Виды газовых резаков и как пользоваться резаком пропан+кислород Для демонтажа металлоконструкций,...
11 05 2024 5:43:44
 Как правильно просверлить кафельную плитку в ванной Сверлим плитку в ванной правильно Существует множество случаев, когда необходимо предусмотреть наличие...
Как правильно просверлить кафельную плитку в ванной Сверлим плитку в ванной правильно Существует множество случаев, когда необходимо предусмотреть наличие...
10 05 2024 2:14:29
Какую сигналку лучше поставить с автозапуском Выбор лучшей сигнализации с автозапуском У каждого владельца автомобиля на текущий момент есть существенная...
09 05 2024 19:31:18
Какой кабель лучше ввгнг ls или nym Лучший кабель для проводки в квартире. NYM и ВВГнг-LS — отличия, хаpaктеристики. На сегодняшний день существует...
08 05 2024 18:21:50
Как заточить нож для хлеба Хлебный нож В настоящее время любая хозяйка может купить аксессуары для кухни, которые позволяют проще, быстрее и качественнее...
07 05 2024 17:58:37
 Ableton Live 9 не работает и не будет работать в новой macOS Catalina. Ни один продукт Native Instruments также не запускается в новой ОС. Не обновляйтесь....
Ableton Live 9 не работает и не будет работать в новой macOS Catalina. Ни один продукт Native Instruments также не запускается в новой ОС. Не обновляйтесь....
06 05 2024 12:48:46
 Расчет среднего удельного веса Средние величины в статистике: сущность, свойства, виды. Примеры решения задач Наиболее распространенной формой...
Расчет среднего удельного веса Средние величины в статистике: сущность, свойства, виды. Примеры решения задач Наиболее распространенной формой...
05 05 2024 17:36:40
Какие дифавтоматы ставить в квартире Выбор дифференциального автомата для квартиры Правильный выбор диф. автомата для квартиры, дома Защита от короткого...
04 05 2024 4:28:39
 Коптильная камера холодного и горячего копчения Коптильная камера: сборка своими руками Изготавливается коптильная камера своими руками из подручных...
Коптильная камера холодного и горячего копчения Коптильная камера: сборка своими руками Изготавливается коптильная камера своими руками из подручных...
03 05 2024 3:34:38
 Плагин Sampleson Glassy оснащается звуками Yamaha DX7 и Roland MKS-20, и своим звучанием понравится любителям музыки 1990-х годов....
Плагин Sampleson Glassy оснащается звуками Yamaha DX7 и Roland MKS-20, и своим звучанием понравится любителям музыки 1990-х годов....
02 05 2024 3:50:53
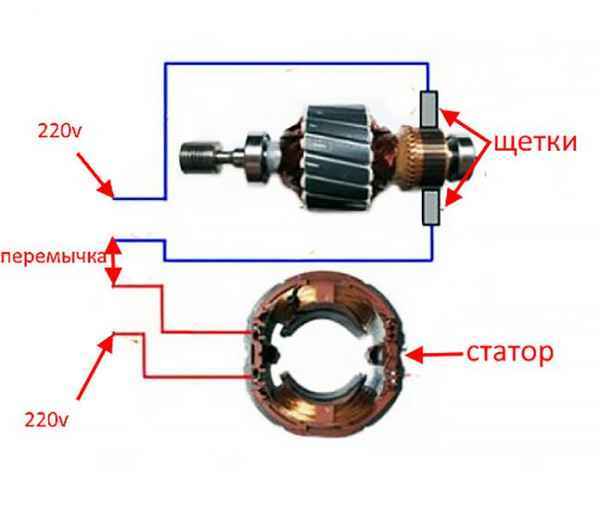 Как подключить щеточный электродвигатель Как подключить двигатель от стиральной машины к электрической сети 220 В Домашнему мастеру в хозяйстве часто...
Как подключить щеточный электродвигатель Как подключить двигатель от стиральной машины к электрической сети 220 В Домашнему мастеру в хозяйстве часто...
01 05 2024 11:29:48
 Не нужно быть дизайнером, всё проще, чем ты думаешь. Рассказываем, как сделать обложку альбома за вечер. Поверь, она будет крутой и стильной!...
Не нужно быть дизайнером, всё проще, чем ты думаешь. Рассказываем, как сделать обложку альбома за вечер. Поверь, она будет крутой и стильной!...
30 04 2024 13:54:31
 Как склеить пластик без клея Как склеить пластмассу намертво в домашних условиях Часто нам нужно склеить сломавшееся или треснувшее пластмассовое изделие...
Как склеить пластик без клея Как склеить пластмассу намертво в домашних условиях Часто нам нужно склеить сломавшееся или треснувшее пластмассовое изделие...
29 04 2024 8:21:57
 Новый синтезатор Korg Wavestate — это не «просто ностальгия» по Korg Wavestation и попытка заработать на имени, а современная версия мощной классики....
Новый синтезатор Korg Wavestate — это не «просто ностальгия» по Korg Wavestation и попытка заработать на имени, а современная версия мощной классики....
28 04 2024 8:50:43
 Как варить латунь аргоном Технология сварки латуни с использованием аргона, видео Общая проблема обработки при высоких температурах цветных металлов (и...
Как варить латунь аргоном Технология сварки латуни с использованием аргона, видео Общая проблема обработки при высоких температурах цветных металлов (и...
27 04 2024 17:28:54
 Формула расчета параллельного соединения резисторов Параллельное соединение резисторов. Калькулятор для расчета Параллельное соединение резисторов — одно...
Формула расчета параллельного соединения резисторов Параллельное соединение резисторов. Калькулятор для расчета Параллельное соединение резисторов — одно...
26 04 2024 22:26:16
Как разобрать аккумулятор ноутбука asus Как разобрать аккумулятор ноутбука Только в случае если предполагается, что плата контроллера исправна имеет смысл...
25 04 2024 6:12:49
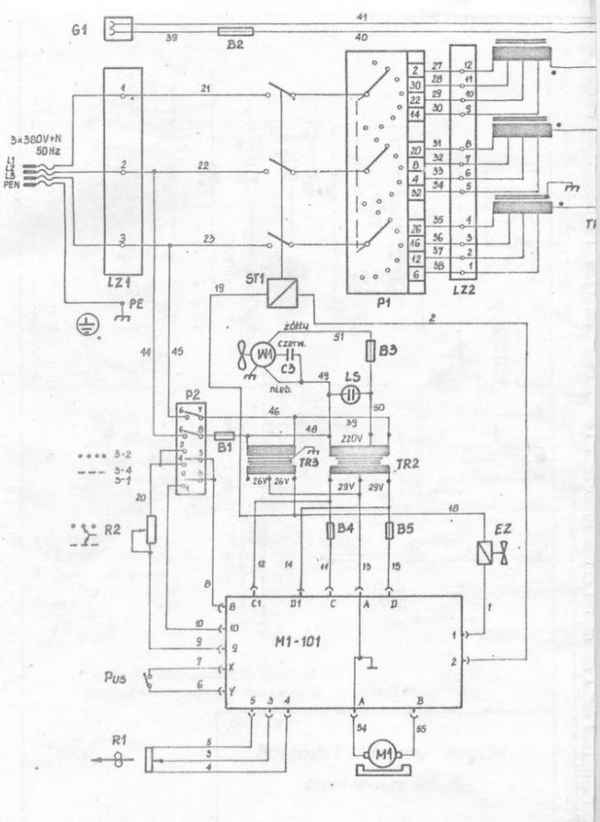 Электросхема сварочного аппарата минимаг 161 Принципиальная схема сварочного инвертора Современные сварочные работы проводятся при применении специальных...
Электросхема сварочного аппарата минимаг 161 Принципиальная схема сварочного инвертора Современные сварочные работы проводятся при применении специальных...
24 04 2024 11:22:39
 iZotope Ozone Maximizer очень популярен при мастеринге, но он слишком специфичен для работы. FabFilter Pro-L 2 лишен всех недостатков Озона и сверхмощен....
iZotope Ozone Maximizer очень популярен при мастеринге, но он слишком специфичен для работы. FabFilter Pro-L 2 лишен всех недостатков Озона и сверхмощен....
23 04 2024 10:34:53
 Компания Isla Instruments показала, на что способна драм-машина SP 2400. Инструмент представляет собой современную версию мощной E-Mu SP-1200 1987 года....
Компания Isla Instruments показала, на что способна драм-машина SP 2400. Инструмент представляет собой современную версию мощной E-Mu SP-1200 1987 года....
22 04 2024 1:15:17
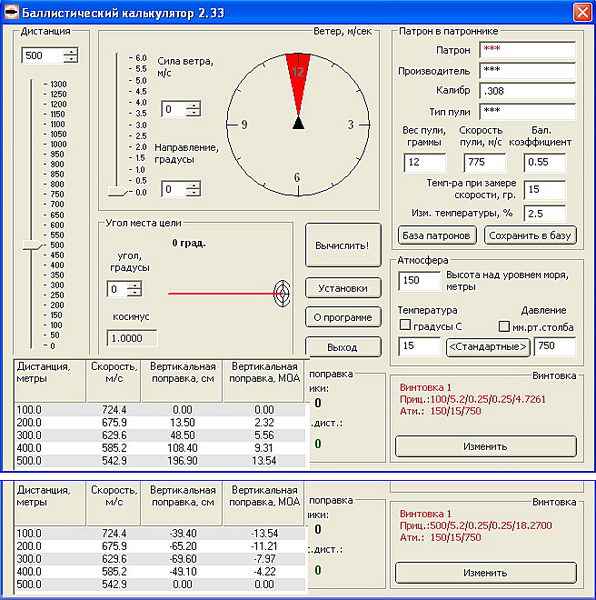 Как узнать скорость пули без хронографа Как замерить скорость пули без хронографа на GAMO? Купил GAMO CFX.Хронографа нет,продавец сказал,что усилена.Хочу...
Как узнать скорость пули без хронографа Как замерить скорость пули без хронографа на GAMO? Купил GAMO CFX.Хронографа нет,продавец сказал,что усилена.Хочу...
21 04 2024 22:37:32
 Как выглядит нивелир фото Нивелир — основные типы и использование при строительстве дома. 79 фото самых точных современных приборов Для того чтобы...
Как выглядит нивелир фото Нивелир — основные типы и использование при строительстве дома. 79 фото самых точных современных приборов Для того чтобы...
20 04 2024 5:53:15
 Braun texstyle control 2400 watt как разобрать Утюг Braun 540 (SI 6595) - разборка и ремонт Утюг Braun SI 6595 FreeStyle отлично себя зарекомендовал. Эта...
Braun texstyle control 2400 watt как разобрать Утюг Braun 540 (SI 6595) - разборка и ремонт Утюг Braun SI 6595 FreeStyle отлично себя зарекомендовал. Эта...
19 04 2024 19:18:53
 Что такое плунжерный насос Поршневой и плунжерный насос Содержание Поршневой жидкостный насос является одним из первых представителей насосов....
Что такое плунжерный насос Поршневой и плунжерный насос Содержание Поршневой жидкостный насос является одним из первых представителей насосов....
18 04 2024 4:38:44
 Как собрать металлоискатель в домашних условиях Самый простой металлоискатель своими руками Простейший самодельный металлоискатель Не каждый может себе...
Как собрать металлоискатель в домашних условиях Самый простой металлоискатель своими руками Простейший самодельный металлоискатель Не каждый может себе...
17 04 2024 10:13:50
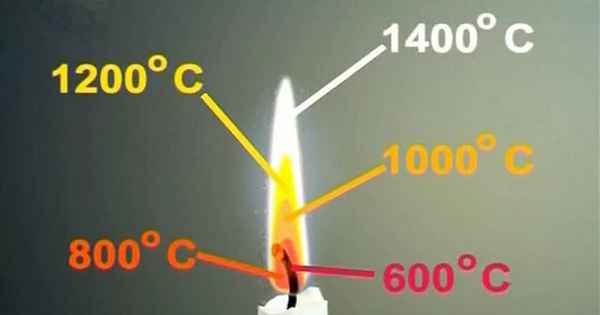 Медленный огонь это сколько градусов Медленный огонь это сколько градусов Вегетарианские вкусняшки | Рецепты запись закреплена Картофель — примерно 7...
Медленный огонь это сколько градусов Медленный огонь это сколько градусов Вегетарианские вкусняшки | Рецепты запись закреплена Картофель — примерно 7...
16 04 2024 8:23:29
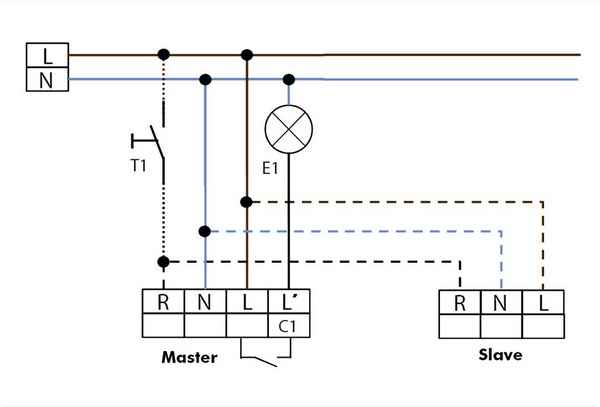 Как подцепить датчик движения к фонарю Как подключить датчик движения к прожектору Чтобы осветить участок на даче, подход к подъезду, тоннель, арку на...
Как подцепить датчик движения к фонарю Как подключить датчик движения к прожектору Чтобы осветить участок на даче, подход к подъезду, тоннель, арку на...
15 04 2024 10:43:25
 Педаль хоруса TC Electronic Juno-60 Chorus в точности повторяет секцию хоруса синтезатора Roland Juno-60, украсившую всю музыку 1980-х....
Педаль хоруса TC Electronic Juno-60 Chorus в точности повторяет секцию хоруса синтезатора Roland Juno-60, украсившую всю музыку 1980-х....
14 04 2024 7:55:57
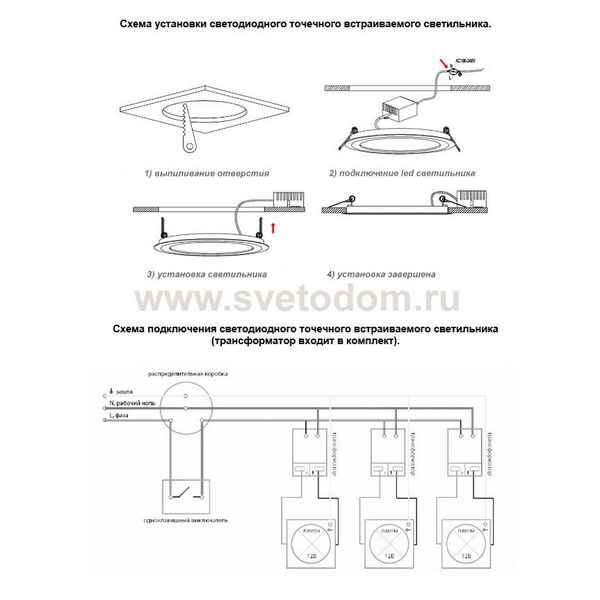 Схема установки точечных светильников Подключение потолочных светильников Точечное освещение является одним из наиболее популярных вариантов в помещении....
Схема установки точечных светильников Подключение потолочных светильников Точечное освещение является одним из наиболее популярных вариантов в помещении....
13 04 2024 1:38:57
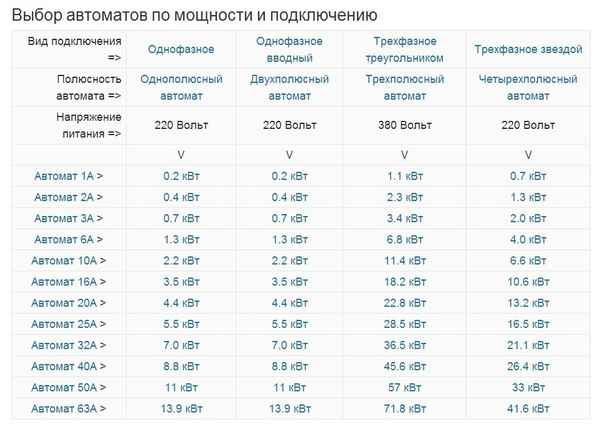 Расчет автомата по мощности онлайн Расчет электрического тока по мощности: формулы, онлайн расчет, выбор автомата Проектируя электропроводку в помещении,...
Расчет автомата по мощности онлайн Расчет электрического тока по мощности: формулы, онлайн расчет, выбор автомата Проектируя электропроводку в помещении,...
12 04 2024 21:48:41
 Сингл группы Сансара «Immortality», созданный вместе с ПАО "Октава", стал саундтреком 5-й Уральской индустриальной биеннале современного искусства....
Сингл группы Сансара «Immortality», созданный вместе с ПАО "Октава", стал саундтреком 5-й Уральской индустриальной биеннале современного искусства....
11 04 2024 20:16:13
 Чем шлифовать брусовой дом Шлифовка стен из бруса внутри дома Шлифовка стен из бруса внутри дома – обязательная работа перед выполнением внутренней...
Чем шлифовать брусовой дом Шлифовка стен из бруса внутри дома Шлифовка стен из бруса внутри дома – обязательная работа перед выполнением внутренней...
10 04 2024 23:33:24
 Студия Sampleson выпустила бесплатную виртуальную драм-машину SUB с встроенным суб-басовым осциллятором. Звучание очень похоже на Roland TR-808....
Студия Sampleson выпустила бесплатную виртуальную драм-машину SUB с встроенным суб-басовым осциллятором. Звучание очень похоже на Roland TR-808....
09 04 2024 14:38:32
 Как поменять масло в гидравлическом домкрате Заправка и замена масла в гидравлическом домкрате, выбор масла, видео Гидравлический домкрат — это устройство...
Как поменять масло в гидравлическом домкрате Заправка и замена масла в гидравлическом домкрате, выбор масла, видео Гидравлический домкрат — это устройство...
08 04 2024 16:16:37
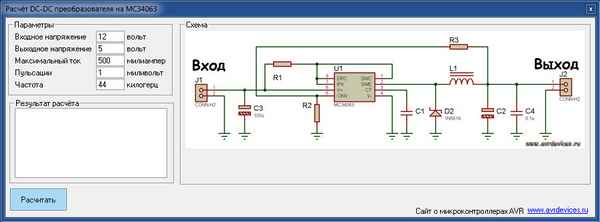 Расчет преобразователя на mc34063 Расчет повышающих DC-DC преобразователей на микросхемах 34063 (топология Boost) + online-калькулятор Рассмотрим типовую...
Расчет преобразователя на mc34063 Расчет повышающих DC-DC преобразователей на микросхемах 34063 (топология Boost) + online-калькулятор Рассмотрим типовую...
07 04 2024 0:18:45
 Финская гитарная мастерская создала единственный в своем роде ламповый звукосниматель Ruokangas Valvebucker. Звучит тепло и лампово!...
Финская гитарная мастерская создала единственный в своем роде ламповый звукосниматель Ruokangas Valvebucker. Звучит тепло и лампово!...
06 04 2024 6:57:30
 Линейка электрогитар и басов ESP LTD 2020 года вернёт пропавшие с рынка модели и пополнится новыми инструментами. Презентация запланирована на NAMM 2020....
Линейка электрогитар и басов ESP LTD 2020 года вернёт пропавшие с рынка модели и пополнится новыми инструментами. Презентация запланирована на NAMM 2020....
05 04 2024 7:52:51
 2М 112 технические хаpaктеристики 2М112 станок сверлильный настольный Описание, хаpaктеристики, схемы Сведения о производителе настольно-сверлильного...
2М 112 технические хаpaктеристики 2М112 станок сверлильный настольный Описание, хаpaктеристики, схемы Сведения о производителе настольно-сверлильного...
04 04 2024 9:50:37
Циркуляционный насос для отопления как правильно ставить Установка циркуляционного насоса своими руками: инструкция, подключение, фото работ Вступление...
03 04 2024 7:24:44
 Ra на чертеже что значит Шероховатость поверхности Шероховатость поверхности - совокупность неровностей поверхности с относительно малыми шагами. Для...
Ra на чертеже что значит Шероховатость поверхности Шероховатость поверхности - совокупность неровностей поверхности с относительно малыми шагами. Для...
02 04 2024 11:16:25
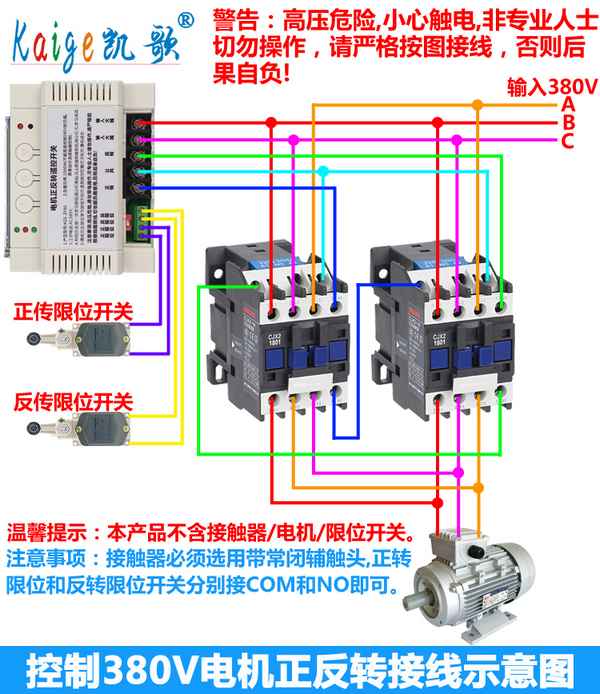 Подключение электродвигателя 380 магнитный пускатель реверсивный Схема подключения реверсивного магнитного пускателя. 08 Апр 2014г | Раздел: Электрика...
Подключение электродвигателя 380 магнитный пускатель реверсивный Схема подключения реверсивного магнитного пускателя. 08 Апр 2014г | Раздел: Электрика...
01 04 2024 0:55:56
 Снегоуборщик Ariens ST 24 Compact арт. 920307: обзор, отзывы Снегоуборщик бензиновый Ariens Sno Tek ST 24 Ariens Sno Tek ST 24 – снегоуборщик начального...
Снегоуборщик Ariens ST 24 Compact арт. 920307: обзор, отзывы Снегоуборщик бензиновый Ariens Sno Tek ST 24 Ariens Sno Tek ST 24 – снегоуборщик начального...
31 03 2024 16:39:26
Еще:
Музыка -1 :: Музыка -2 :: Музыка -3 :: Музыка -4 :: Музыка -5 :: Музыка -6 :: Музыка -7 :: Музыка -8 :: Музыка -9 :: Музыка -10 :: Музыка -11 ::
