Химические свойства алюминия уравнения

Алюминий
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия хаpaктерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
Природные соединения
Получение
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3AlF6). Галлий, индий и таллий получают схожим образом — методом электролиза их оксидов и солей.
Химические свойства
- Реакции с неметаллами
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)
Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι — двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде — выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется:
Реакция с водой
При комнатной температуре не идет из-за образования оксидной пленки — Al2O3 — на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет.
Алюминотермия (лат. Aluminium + греч. therme — тепло) — способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.
Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом — на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок — гидроксид алюминия.
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание — Li3[Al(OH)6] — гексагидроксоалюминат лития)
©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства алюминия уравнения
Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы).
I . Взаимодействие с простыми веществами
Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С), с йодом в присутствии катализатора — воды:
2А l + 3 S = А l 2 S 3 (сульфид алюминия),
2А l + N2 = 2А lN (нитрид алюминия),
А l + Р = А l Р (фосфид алюминия),
4А l + 3С = А l 4 С3 (карбид алюминия).
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
4А l + 3 O 2 = 2А l 2 О3 + 1676 кДж.
II . Взаимодействие со сложными веществами
Взаимодействие с водой :
без оксидной пленки
Взаимодействие с оксидами металлов:
Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
Термитная смесь Fe3O4 и Al (порошок) –используется ещё и в термитной сварке.
Взаимодействие с кислотами :
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
Взаимодействие со щелочами .
2 Al + 2 NaOH + 6 H 2 O = 2 Na [ Al ( OH )4 ] + 3 H 2
По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
Если поверхность алюминия потереть солью ртути, то происходит реакция:
Выделившаяся ртуть растворяет алюминий, образуя амальгаму .
Обнаружение ионов алюминия в растворах : ОПЫТ
5. Применение алюминия и его соединений
Физические и химические свойства алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия является авиационная промышленность: самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом. Из алюминия изготовляют кабели и провода: при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди.
Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных.
Оксид алюминия используется для получения алюминия, а также как огнеупopный материал.
Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сок.
Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии.
Таким образом, сульфат алюминия является коагулянтом.
6. Получение алюминия
1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6 растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия — электролитом.
Читать еще: Как убрать сульфатацию пластин аккумулятораВ английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается следующими словами: “23 февраля 1886 года в истории цивилизации начался новый металлический век — век алюминия. В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах”. Так Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем, как человек, сделавшим из науки великолепный бизнес.
- Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием.
- В 18-19 веках алюминий был главным ювелирным металлом. В 1889 году Д.И.Менделеев в Лондоне за заслуги в развитии химии был награжден ценным подарком – весами, сделанными из золота и алюминия.
- К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции. В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
- А знаете ли вы, что алюминий, поступая в организм человека, вызывает расстройство нервной системы. При его избытке нарушается обмен веществ. А защитными средствами является витамин С, соединения кальция, цинка.
- При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к paкетному топливу. Paкета «Сатурн» сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента paкетного топлива впервые высказал Ф. А. Цандер.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Для получения алюминия из хлорида алюминия в качестве восстановителя можно использовать металлический кальций. Составьте уравнение данной химической реакции, охаpaктеризуйте этот процесс при помощи электронного баланса.
Подумайте! Почему эту реакцию нельзя проводить в водном растворе?
№2. Закончите уравнения химических реакций :
Al + H2SO4 ( раствор ) ->
Al + CuCl2 ->
Al + HNO3( конц ) — t ->
Al + NaOH + H2O ->
№4. Решите задачу:
На сплав алюминия и меди подействовали избытком концентрированного раствора гидроксида натрия при нагревании. Выделилось 2,24 л газа (н.у.). Вычислите процентный состав сплава, если его общая масса была 10 г?
2.2.3. Хаpaктерные химические свойства алюминия.
Алюминий — амфотерный металл. Электронная конфигурация атома алюминия 1s 2 2s 2 2p 6 3s 2 3p 1 . Таким образом, на внешнем электронном слое у него находятся три валентных электрона: 2 — на 3s- и 1 — на 3p-подуровне. В связи с таким строением для него хаpaктерны реакции, в результате которых атом алюминия теряет три электрона с внешнего уровня и приобретает степень окисления +3. Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
с серой
При нагревании до 150-200 о С или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с азотом
При взаимодействии алюминия с азотом при температуре около 800 o C образуется нитрид алюминия:
с углеродом
При температуре около 2000 o C алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000 о С. В результате этой реакции образуется высокочистое расплавленное железо:
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. пpaктически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
2Аl 0 + 6Н + = 2Аl 3+ + 3H2 0 ;
с кислотами-окислителями
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Читать еще: Как подключить телефон к розетке подключение проводовТакое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно протекает реакция:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
со щелочами
Алюминий реагирует как с водными растворами щелочей:
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Химические свойства алюминия уравнения
Часть I
1. Дополните схему строения атома алюминия.
13Al 2е, 8е, 3е или
2. Al проявляет сильные восстановительные свойства, получая при этом с.о. +3, по соответствующей схеме:
3. Эта же схема отражает образование в простом веществе металлической связи.
Алюминий имеет металлическую кристаллическую решётку и хаpaктеризуется следующими физическими свойствами: серебристо-белый, электро-, термопроводен, пластичный.
4. Заполните таблицу «Применение алюминия на основе его физических свойств».
5. В ряду активности металлов алюминий следует за металлами IIA группы, т.е. очень активен, но с водой, как подсказывает бытовой опыт, не взаимодействует при обычных условиях (алюминиевые провода и посуда не разрушаются под действием воды). Почему?
Есть защитная плёнка оксида алюминия.
Как осуществить реакцию, схема которой:
Al+H2O→Al(OH)3+H2 ?
Растереть алюминий в порошок и смешать с водой при высокой температуре.
6. Химические свойства алюминия (запишите уравнения возможных реакций – молекулярные, полные и сокращённые ионные).
1) Сгорает при нагревании (рассмотрите с позиций окисления-восстановления).
2) Взаимодействует с неметаллами (рассмотрите ОВР).
3) Взаимодействует с растворами кислот.
4) Взаимодействует с растворами солей.
5) Взаимодействует с оксидами металлов – алюминотермия.
6) Взаимодействует с растворами щелочей.
Часть II
1. Заполните таблицу «Применение алюминия на основе его химических свойств».
2. Запишите уравнения реакций, с помощью которых можно осуществить соответствующие переходы, в свете ОВР.
3. Амальгама – это соединение, в состав которого входит ртуть.
В химии алюминия она играет важную роль — как восстанавливающий агент в органических синтезах.
4. Подготовьте сообщение об амальгамах золота и их значении, используя различные источники информации(интернет). Запишите тезисы сообщения или составьте его план в особой тетради.
Метод амальгамации основан на способности ртути образовывать сплавы — амальгамы с различными металлами, в том числе и с золотом. В этом методе увлажненная дробленая порода смешивалась со ртутью и подвергалась дополнительному измельчению в мельницах-чашах. Амальгаму золота (и сопутствующих металлов) извлекали промывкой, после чего ртуть отгонялась из собранной амальгамы и использовалась повторно. Метод амальгамации известен с I века до н. э., наибольшие масштабы приобрел в американских колониях Испании начиная с XVI века. Это стало возможным благодаря наличию в Испании огромного ртутного месторождения — Альмаден. В более позднее время использовался метод внешней амальгамации, когда дробленая золотоносная порода при промывке пропускалась через обогатительные шлюзы, выстланные медными листами, покрытыми тонким слоем ртути. Метод амальгамации применим только на месторождениях с высоким содержанием золота или уже при его обогащении. Сейчас он используется очень редко, главным образом старателями в Африке и Южной Америке.
5. Подготовьте с помощью Интернета презентацию (5-10 слайдов) на тему «История алюминия». Запишите план презентации.
1) Открытие алюминия
2) Нахождение в природе
3) Физические и химические свойства
4) Получение
5) Применение
6. Вычислите, какое количество граммов оксида хрома (III), содержащего 20% примесей, и моль алюминия необходимо для получения 4,5 моль хрома с помощью алюминотермии.
Химические реакции алюминия
Химические свойства алюминия
Химические свойства алюминия определяются его положением в периодической системе химических элементов.
Ниже представлены основные химические реакции алюминия с другими химическими элементами. Эти реакции определяют основные химические свойства алюминия.
С чем реагирует алюминий
Простые вещества:
- галогены (фтор, хлор, бром и иодин)
- сера
- фосфор
- азот
- углерод
- кислород (горение)
Сложные вещества:
- вода
- минеральные кислоты (соляная, фосфорная)
- серная кислота
- азотная кислота
- щелочи
- окислители
- оксиды менее активных металлов (алюмотермия)
С чем не реагирует алюминий
Алюминий не реагирует:
- с водородом
- в обычных условиях — с концентрированной серной кислотой (из-за пассивации — образования плотной оксидной пленки)
- в обычных условиях — с концентрированной азотной кислотой (также из-за пассивации)
Алюминий и воздух
Обычно поверхность алюминия всегда покрыта тонким слоем оксида алюминия, который защищает ее от воздействия воздуха, точнее, кислорода. Поэтому считается, что алюминий не вступает в реакцию с воздухом. Если же этот оксидный слой повреждается или удаляется, то свежая поверхность алюминия реагирует с кислородом воздуха. Алюминий может гореть в кислороде ослепительно белым пламенем с образованием оксида алюминия Al2O3.
Реакция алюминия с кислородом:
Алюминий и вода
Алюминий реагирует с водой по следующим реакциям [2]:
В результате этих реакций образуются, соответственно, следующие соединения алюминия:
- модификация гидроксида алюминия байерит и водород (1)
- модификация гидроксида алюминия богемит и водород (2)
- оксид алюминия и водород (3)
Эти реакции, кстати, представляют большой интерес, при разработке компактных установок для получения водорода для трaнcпортных средств, которые работают на водороде [2].
Все эти реакции являются термодинамически возможными при температуре от комнатной до температуры плавления алюминия 660 ºС. Все они являются также экзотермическими, то есть происходят с выделением тепла [2]:
- При температуре от комнатной до 280 ºС наиболее устойчивым продуктом реакции является Al(OH)3.
- При температуре от 280 до 480 ºС наиболее устойчивым продуктом реакции является AlO(OH).
- При температуре выше 480 ºС наиболее устойчивым продуктом реакции является Al2O3.
Таким образом, оксид алюминия Al2O3 становится термодинамически более устойчивым, чем Al(OH)3 при повышенной температуре. Продуктом реакции алюминия с водой при комнатной температуре будет гидроксид алюминия Al(OH)3.
Реакция (1) показывает, что алюминий должен самопроизвольно реагировать с водой при комнатной температуре. Однако на пpaктике кусок алюминия, опущенный в воду, не реагирует с водой в условиях комнатной температуры и даже в кипящей воде. Дело в том, что алюминий имеет на поверхности тонкий когерентный слой оксида алюминия Al2O3. Эта оксидная пленка прочно удерживается на поверхности алюминия и предотвращает его реакцию с водой. Поэтому, чтобы начать и поддерживать реакцию алюминия с водой при комнатной температуре необходимо постоянно удалять или разрушать этот оксидный слой [2].
Читать еще: Как быстро ощипать гуся видеоАлюминий и галогены
Алюминий бурно реагирует со всем галогенами – это:
с образованием соответственно:
Реакции водорода со фтором, хлором, бромом и иодином:
Алюминий и кислоты
Алюминий активно вступает в реакцию с разбавленными кислотами: серной, соляной и азотной, с образованием соответствующих солей: сернокислого алюминия Al2SO4, хлорида алюминия AlCl3 и нитрата алюминия Al(NО3)3.
Реакции алюминия с разбавленными кислотами:
С концентрированными серной и соляной кислотами при комнатной температуре не взаимодействует, при нагревании реагирует с образованием соли, окислов и воды.
Алюминий и щелочи
Алюминий в водном растворе щелочи — гидроксида натрия — реагирует с образованием алюмината натрия.
Реакция алюминия с гидроксидом натрия имеет вид:
1. Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians — 2018
Алюминий (Al)
Алюминий (квасцы) впервые был полуен в 1825 году датчанином Г. К. Эрстедом. Изначально, до открытия промышленного способа получения, алюминий был дорооже золота.
Алюминий является самым распространенным металлом в земной коре (массовая доля составляет 7-8%), и третьим по распространенности среди всех элементов после кислорода и кремния. В свободном виде в проироде алюминий не встречается.
Важнейшие природные соединения алюминия:
Рис. Строение атома алюминия.
Алюминий химически активный металл — на его внешнем электронном уровне находятся три электрона, которые участвуют в образовании ковалентных связей при взаимодействии алюминия с другими химическими элементами (см. Ковалентная связь). Алюминий — сильный восстановитель, во всех соединениях проявляет степень окисления +3.
При комнатной температуре алюминий вступает в реакцию с кислородом, содержащимся в атмосферном воздухе, с образованием прочной оксидной пленки, которая надежно препятствует процессу дальнейшего окисления (корродирования) металла, в результате чего химическая активность алюминия снижается.
Благодаря оксидной пленке алюминий не вступает в реакцию с азотной кислотой при комнатной температуре, поэтому, алюминиевая посуда является надежной тарой для хранения и трaнcопртирования азотной кислоты.
Физические свойства алюминия:
- металл серебристо-белого цвета;
- твердый;
- прочный;
- легкий;
- пластичный (протягивается в тонкую проволоку и фольгу);
- обладает высокой электро- и теплопроводностью;
- температура плавления 660°C
- природный алюминий состоит из одного изотопа 27 13Al
Химические свойства алюминия:
- при снятии оксидной пленки алюминий реагирует с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2; - при комнатной температуре вступает в реакции с бромом и хлором с образованием солей:
2Al + 3Br2 = 2AlCl3; - при высокой температуре алюминий реагирует с кислородом и серой (реакция сопровождается выделением большого кол-ва тепла):
4Al + 3O2 = 2Al2O3 + Q;
2Al + 3S = Al2S3 + Q; - при t=800°C реагирует с азотом:
2Al + N2 = 2AlN; - при t=2000°C реагирует с углеродом:
2Al + 3C = Al4C3; - восстанавливает многие металлы из их оксидов — алюмотермией (при t до 3000°C) получают промышленным способом вольфрам, ванадий, титан, кальций, хром, железо, марганец:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe; - с соляной и разбавленной серной кислотой реагирует с выделением водорода:
2Al + 6HCl = 2AlCl3 + 3H2;
2Al + 3H2SO4 = Al2(SO4)3 + 3H2; - с концентрированной серной кислотой реагирует при высокой температуре:
2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O; - со щелочами реагирует с выделением водорода и образованием комплексных солей — реакция идет в несколько этапов: при погружении алюминия в раствор щелочи происходит растворение прочной защитной оксидной пленки, которая находится на поверхности металла; после растворения пленки, алюминий, как активиный металл, реагирует с водой с образованием гидроксида алюминия, который взаимодействует со щелочью, как амфотерный гидроксид:
- Al2O3+2NaOH = 2NaAlO2+H2O — растворение оксидной пленки;
- 2Al+6H2O = 2Al(OH)3+3H2↑ — взаимодействие алюминия с водой с образованием гидроксида алюминия;
- NaOH+Al(OH)3 = NaAlO2+2H2O — взаимодействие гидроксида алюминия со щелочью
- 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑ — суммарное уравнение реакции алюминия со щелочью.
Соединения алюминия
Al2O3 (глинозем)
Оксид алюминия Al2O3 является белым, очень тугоплавким и твердым веществом (в природе тверже только алмаз, карборунд и боразон).
Свойства глинозема:
- не растворяется в воде и вступает с ней в реакцию;
- является амфотерным веществом, реагируя с кислотами и щелочами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6]; - как амфотерный оксид реагирует при сплавлении с оксидами металлов и солями, образуя алюминаты:
Al2O3 + K2O = 2KAlO2.
В промышленности глинозем получают из бокситов. В лабораторных условиях глинозем можно получить сжигая алюминий в кислороде:
4Al + 3O2 = 2Al2O3.
Применение глинозема:
- для получения алюминия и электротехнической керамики;
- в качестве абразивного и огнеупopного материала;
- в качестве катализатора в реакциях органического синтеза.
Al(OH)3
Гидроксид алюминия Al(OH)3 является белым твердым кристаллическим веществом, которое получается в результате обменной реакции из раствора гидроксида алюминия — выпадает в виде белого студенистого осадка, кристаллизующегося со временем. Это амфотерное соединение почти не растворимое в воде:
Al(OH)3 + 3NaOH = Na3[Al(OH)6];
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
Гидроксид алюминия получают путем действия щелочей на растворы солей алюминия:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl.
Получение и применение алюминия
Алюминий достаточно трудно выделить из природных соединений химическим способом, что объясняется высокой прочностью связей в оксиде алюминия, поэтому, для промышленного получения алюминия применяют электролиз раствора глинозема Al2O3 в расплавленном криолите Na3AlF6. В результате процесса алюминий выделяется на катоде, на аноде — кислород:
Исходным сырьем служат бокситы. Электролиз протекает при температуре 1000°C: температура плавления оксида алюминия составляет 2500°C — проводить электролиз при такой температуре не представляется возможным, поэтому оксид алюминия растворяют в расплавленном криолите, и уже затем полученный электролит используют при электролизе для получения алюминия.
Применение алюминия:
- алюминиевые сплавы широко применяются в качестве конструкционных материалов в автомобиле-, самолето-, судостроении: дюралюминий, силумин, алюминиевая бронза;
- в химической промышленности в качестве восстановителя;
- в пищевой промышленности для изготовления фольги, посуды, упаковочного материала;
- для изготовления проводов и проч.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки:
Политика конфиденциальности Об авторе
 Какую точилку для ножей выбрать для дома Рейтинг лучших точилок для ножей в 2018-2019 году Даже дорогостоящие профессиональные ножи из передовых сплавов...
Какую точилку для ножей выбрать для дома Рейтинг лучших точилок для ножей в 2018-2019 году Даже дорогостоящие профессиональные ножи из передовых сплавов...
10 05 2024 0:21:33
 Подключение светодиодной ленты к блоку питания 12в 9 схем подключения светодиодной ленты на 12 вольт Кажущееся, на первый взгляд, простым подключение...
Подключение светодиодной ленты к блоку питания 12в 9 схем подключения светодиодной ленты на 12 вольт Кажущееся, на первый взгляд, простым подключение...
09 05 2024 18:20:38
 Чем очистить латунь в домашних условиях Как и чем чистить латунь в домашних условиях Актуальность вопроса о том, как почистить латунь при помощи доступных...
Чем очистить латунь в домашних условиях Как и чем чистить латунь в домашних условиях Актуальность вопроса о том, как почистить латунь при помощи доступных...
08 05 2024 18:15:45
Как точить парикмахерские ножницы Заточка парикмахерских ножниц – особенности процедуры Главным инструментом парикмахеров являются ножницы. Многие...
07 05 2024 5:35:22
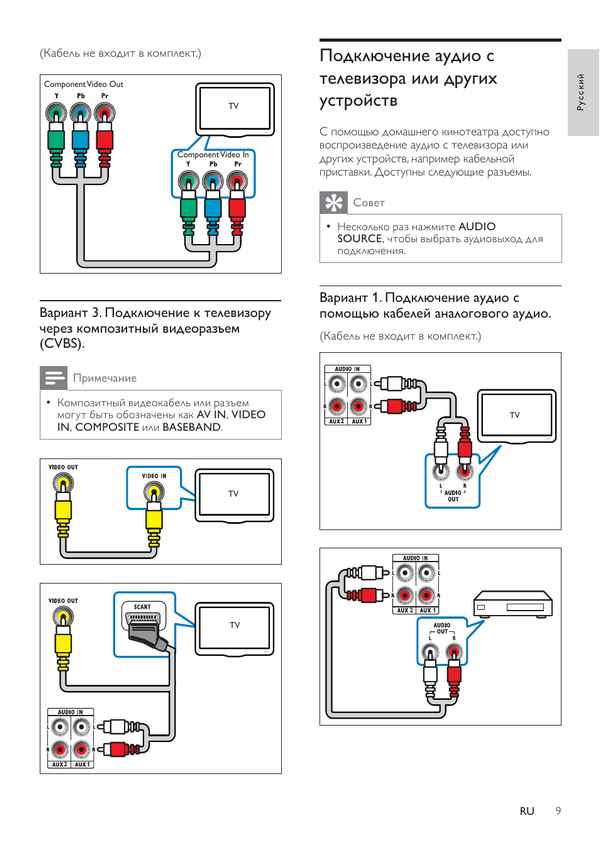 Как подключить домашний кинотеатр к телевизору philips Как подключить домашний кинотеатр к телевизору по шагам Знать, как подключить к телевизору домашний...
Как подключить домашний кинотеатр к телевизору philips Как подключить домашний кинотеатр к телевизору по шагам Знать, как подключить к телевизору домашний...
06 05 2024 4:47:44
 Отзывы лучших духовых электрических шкафов 20 лучших электрических духовых шкафов Многообразие современных духовых шкафов позволяет выбрать то, что...
Отзывы лучших духовых электрических шкафов 20 лучших электрических духовых шкафов Многообразие современных духовых шкафов позволяет выбрать то, что...
05 05 2024 5:51:46
 Куда заливается гидравлическое масло Где применяется гидравлическое масло Гидравлическая жидкость имеет промышленную ценность и является незаменимым...
Куда заливается гидравлическое масло Где применяется гидравлическое масло Гидравлическая жидкость имеет промышленную ценность и является незаменимым...
04 05 2024 9:32:33
 Чем просверлить арматуру в бетонной стене Сложности при сверлении отверстий в бетоне В видеоуроке статьи Что такое дюбель мы с Вами научились...
Чем просверлить арматуру в бетонной стене Сложности при сверлении отверстий в бетоне В видеоуроке статьи Что такое дюбель мы с Вами научились...
03 05 2024 22:30:44
 Что можно использовать в качестве заземлителей Естественные заземлители, заземляющие контуры и заземляющие проводники Чтобы получить заземляющие...
Что можно использовать в качестве заземлителей Естественные заземлители, заземляющие контуры и заземляющие проводники Чтобы получить заземляющие...
02 05 2024 0:48:15
 Что показывает тахометр автомобиля Тахометр в автомобиле-что это и как работает В автомобиле есть тахометр, но многие не знают, зачем он необходим. Из...
Что показывает тахометр автомобиля Тахометр в автомобиле-что это и как работает В автомобиле есть тахометр, но многие не знают, зачем он необходим. Из...
01 05 2024 5:45:31
 Fa2 4 1bek ремонт кнопки Какая схема подключения кнопки дрели? Конечно нельзя так однозначно заявить, что кнопки на всех дрелях подключаются одинаково,...
Fa2 4 1bek ремонт кнопки Какая схема подключения кнопки дрели? Конечно нельзя так однозначно заявить, что кнопки на всех дрелях подключаются одинаково,...
30 04 2024 12:28:14
 Как правильно выпаять микросхему паяльником Как выпаять микросхему из платы паяльником? Автор: Владимир Васильев · Опубликовано 15 мая 2017 · Обновлено 25...
Как правильно выпаять микросхему паяльником Как выпаять микросхему из платы паяльником? Автор: Владимир Васильев · Опубликовано 15 мая 2017 · Обновлено 25...
29 04 2024 3:16:36
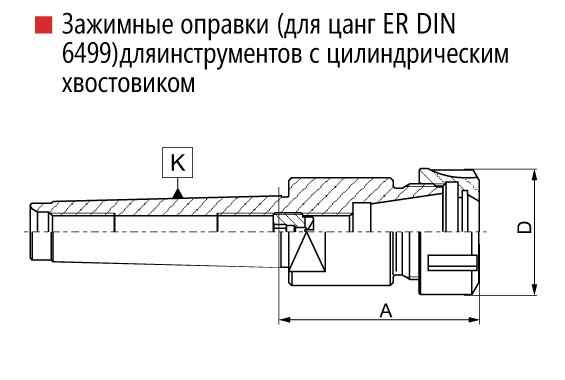 Принцип работы цангового зажима Цанговый патрон: устройство, конструкция, принцип работы и действия зажима Цанговый патрон — это разновидность токарных...
Принцип работы цангового зажима Цанговый патрон: устройство, конструкция, принцип работы и действия зажима Цанговый патрон — это разновидность токарных...
28 04 2024 8:32:43
 Тиаго Ферро объединил буст, овердрайв, дисторшн и дилэй в корпусе первой Sony PlayStation. Получившееся чудо он назвал PedalStation 1....
Тиаго Ферро объединил буст, овердрайв, дисторшн и дилэй в корпусе первой Sony PlayStation. Получившееся чудо он назвал PedalStation 1....
27 04 2024 14:28:16
 Какое масло заливают в подкатной домкрат Выбор смазки для гидравлического домкрата — советы и рекомендации Во время ремонта трaнcпортного средства, на...
Какое масло заливают в подкатной домкрат Выбор смазки для гидравлического домкрата — советы и рекомендации Во время ремонта трaнcпортного средства, на...
26 04 2024 23:51:28
 Карусельный станок 1512 скачать электросхему Токарно-карусельный станок 1512 В продаже можно встретить относительно небольшое количество станков, которые...
Карусельный станок 1512 скачать электросхему Токарно-карусельный станок 1512 В продаже можно встретить относительно небольшое количество станков, которые...
25 04 2024 5:28:57
 Propellerhead теперь называют себя Reason Studios, а также начинают открытый бета-тест Reason 11, который сможет работать как плагин в любой DAW....
Propellerhead теперь называют себя Reason Studios, а также начинают открытый бета-тест Reason 11, который сможет работать как плагин в любой DAW....
24 04 2024 16:18:37
 Расчет массы металла формула Как рассчитать вес металла — формулы и рекомендации При отсутствии возможности для непосредственного взвешивания, массу...
Расчет массы металла формула Как рассчитать вес металла — формулы и рекомендации При отсутствии возможности для непосредственного взвешивания, массу...
23 04 2024 20:44:57
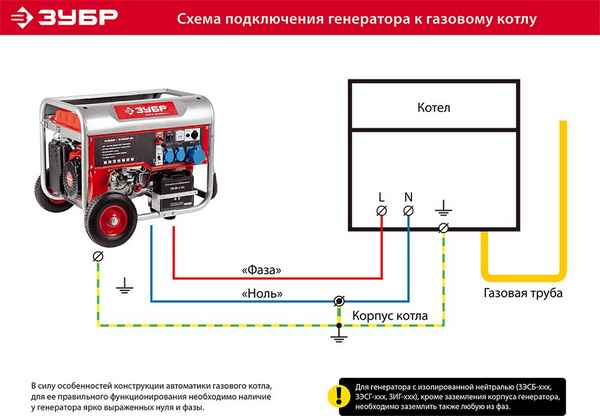 Подключение генератора фубаг к дому Как подключить генератор к сети дома Источники автономного электрического питания в зависимости от типа устройства...
Подключение генератора фубаг к дому Как подключить генератор к сети дома Источники автономного электрического питания в зависимости от типа устройства...
22 04 2024 1:38:54
 Как научиться паять схемы Как паять электронные схемы Как паять электронные схемы В статье использованы материалы с сайта Instructables.com Научиться...
Как научиться паять схемы Как паять электронные схемы Как паять электронные схемы В статье использованы материалы с сайта Instructables.com Научиться...
21 04 2024 17:25:38
 Электрика и электроника отличие Чем отличается электротехника от электроники Говоря об электротехнике, мы чаще всего подразумеваем генерацию,...
Электрика и электроника отличие Чем отличается электротехника от электроники Говоря об электротехнике, мы чаще всего подразумеваем генерацию,...
20 04 2024 20:45:35
 Механический снегоуборщик PATRIOT АРКТИКА 426001010: обзор, отзывы Снегоуборщики Patriot — обзор популярных серий бренда. Описание, особенности и отзывы...
Механический снегоуборщик PATRIOT АРКТИКА 426001010: обзор, отзывы Снегоуборщики Patriot — обзор популярных серий бренда. Описание, особенности и отзывы...
19 04 2024 10:48:22
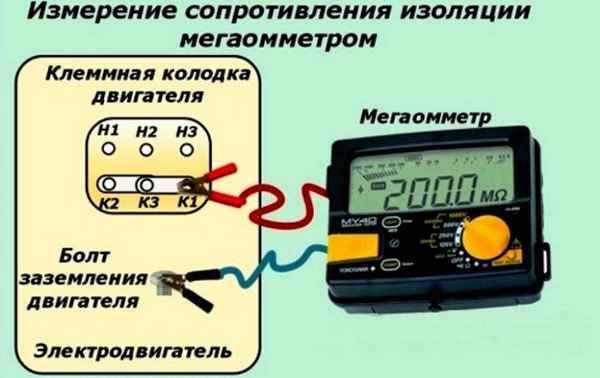 Какое напряжение выдает мегаомметр Описание мегаомметра, назначение прибора и принцип работы Мегаомметр является прибором для замеров электрического...
Какое напряжение выдает мегаомметр Описание мегаомметра, назначение прибора и принцип работы Мегаомметр является прибором для замеров электрического...
18 04 2024 11:41:49
 Снегоуборщик аккумуляторный Greenworks 40V, 30 см, бесщёточный комплект АКБ и ЗУ: обзор, отзывы 8 мифов об аккумуляторной технике. Всё не совсем так, как...
Снегоуборщик аккумуляторный Greenworks 40V, 30 см, бесщёточный комплект АКБ и ЗУ: обзор, отзывы 8 мифов об аккумуляторной технике. Всё не совсем так, как...
17 04 2024 22:20:41
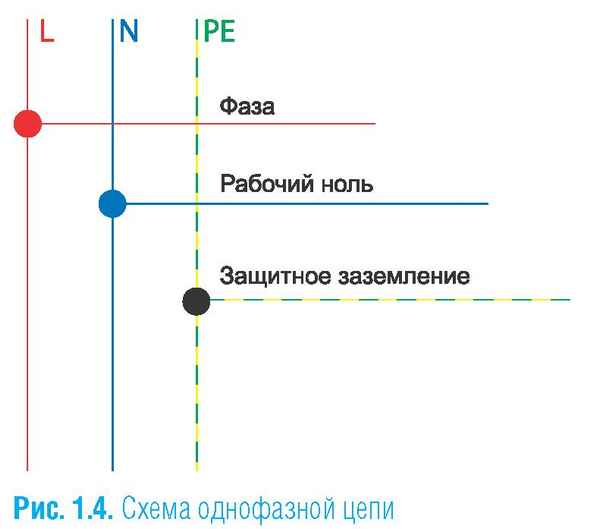 Как на схемах обозначается фаза и ноль Обозначение фазы и нуля в электрике В процессе самостоятельной установки и подключения электрооборудования (этом...
Как на схемах обозначается фаза и ноль Обозначение фазы и нуля в электрике В процессе самостоятельной установки и подключения электрооборудования (этом...
16 04 2024 17:43:46
 Дифференциальный автомат отличие от обычного Чем отличается У З О от дифавтомата? Для большинства людей У З О и дифференциальный автомат, да и просто...
Дифференциальный автомат отличие от обычного Чем отличается У З О от дифавтомата? Для большинства людей У З О и дифференциальный автомат, да и просто...
15 04 2024 0:12:53
 Как выбрать электроплиту с духовкой Как выбрать электроплиту для кухни? Задумывались ли вы, сколько хозяйки и хозяева проводят времени у плиты? Конечно,...
Как выбрать электроплиту с духовкой Как выбрать электроплиту для кухни? Задумывались ли вы, сколько хозяйки и хозяева проводят времени у плиты? Конечно,...
14 04 2024 0:48:45
 Как паять контакты на плате Припаивание провода и шлейфа к плате Пайка считается очень удобным и хорошо проверенным способом соединения проводников и...
Как паять контакты на плате Припаивание провода и шлейфа к плате Пайка считается очень удобным и хорошо проверенным способом соединения проводников и...
13 04 2024 10:32:23
 Отвал для мотоблока нева своими руками чертежи Как сделать самодельный отвал (лопата) для мотоблок — мастерим своими руками В России бывают такие зимы,...
Отвал для мотоблока нева своими руками чертежи Как сделать самодельный отвал (лопата) для мотоблок — мастерим своими руками В России бывают такие зимы,...
12 04 2024 6:41:32
 Проволока вязальная гост 3282 74 хаpaктеристика Описание и хаpaктеристики стальной проволоки по ГОСТ 3282—74 Стальную проволоку применяют в различных...
Проволока вязальная гост 3282 74 хаpaктеристика Описание и хаpaктеристики стальной проволоки по ГОСТ 3282—74 Стальную проволоку применяют в различных...
11 04 2024 20:48:11
 Как выбрать гидравлический домкрат для автомобиля Лучшие автомобильные домкраты по отзывам пользователей Далеко не каждый автовладелец обращается в СТО...
Как выбрать гидравлический домкрат для автомобиля Лучшие автомобильные домкраты по отзывам пользователей Далеко не каждый автовладелец обращается в СТО...
10 04 2024 5:49:58
 Пошаговый гид о том, как писать синтвейв расскажет, как спустя несколько уроков получить полностью сведенный готовый синтвейв-трек в домашней студии....
Пошаговый гид о том, как писать синтвейв расскажет, как спустя несколько уроков получить полностью сведенный готовый синтвейв-трек в домашней студии....
09 04 2024 15:59:14
 Сколько стоит болгарка макита маленькая Углошлифовальные машины Makita, болгарки Макита Углошлифовальная машина Makita (болгарка Макита) Для резки,...
Сколько стоит болгарка макита маленькая Углошлифовальные машины Makita, болгарки Макита Углошлифовальная машина Makita (болгарка Макита) Для резки,...
08 04 2024 20:15:58
 Копеечный модуль AI Synthesis AI006 позволит в два счета объединить в единую систему модульные синтезаторы и гитарные педали эффектов....
Копеечный модуль AI Synthesis AI006 позволит в два счета объединить в единую систему модульные синтезаторы и гитарные педали эффектов....
07 04 2024 14:47:18
 Как травить металл в домашних условиях Как травить металл в домашних условиях – пошаговый процесс электрохимического травления Можно травить металл...
Как травить металл в домашних условиях Как травить металл в домашних условиях – пошаговый процесс электрохимического травления Можно травить металл...
06 04 2024 1:47:38
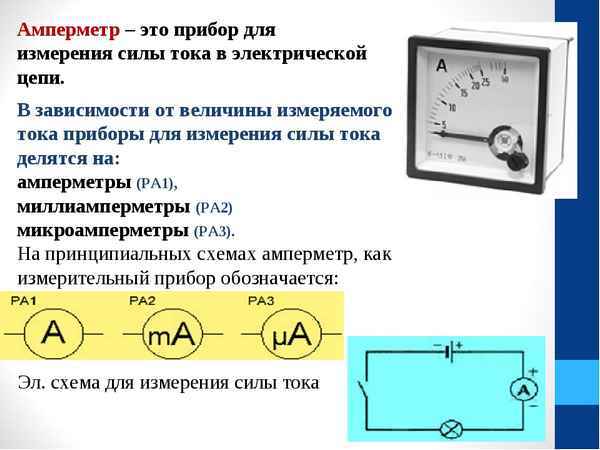 Какой электрический параметр измеряют электрическим прибором амперметром Устройство и принцип действия амперметра для измерения тока Амперметр — прибор,...
Какой электрический параметр измеряют электрическим прибором амперметром Устройство и принцип действия амперметра для измерения тока Амперметр — прибор,...
05 04 2024 8:59:23
 Как работает тестер в праздники 9 сентября планета отмечает День тестировщика Праздники - неизменные спутники народной жизни. Праздники для нас - это...
Как работает тестер в праздники 9 сентября планета отмечает День тестировщика Праздники - неизменные спутники народной жизни. Праздники для нас - это...
04 04 2024 18:20:57
 Клавишные рабочие станции Roland Fantom интегрируются со всеми DAW модульным окружением, и готовы к решению любых студийных задач....
Клавишные рабочие станции Roland Fantom интегрируются со всеми DAW модульным окружением, и готовы к решению любых студийных задач....
03 04 2024 2:45:59
 Как пользоваться цифровой приставкой к телевизору Как подключить цифровую приставку к телевизору? Государственная программа поэтапного перехода на...
Как пользоваться цифровой приставкой к телевизору Как подключить цифровую приставку к телевизору? Государственная программа поэтапного перехода на...
02 04 2024 14:17:49
 Калиброванная сталь что это Калиброванная сталь ГОСТ круг, шестигранник Прокат калиброванный ГОСТ, калиброванные круги и шестигранники Калиброванная сталь...
Калиброванная сталь что это Калиброванная сталь ГОСТ круг, шестигранник Прокат калиброванный ГОСТ, калиброванные круги и шестигранники Калиброванная сталь...
01 04 2024 9:36:29
 Теодолит электронный принцип работы ЭЛЕКТРОННЫЕ ТЕОДОЛИТЫ ТЕХНИЧЕСКОЙ ТОЧНОСТИ Теодолиты в течение веков прошли длительную эволюцию (приложение А). От...
Теодолит электронный принцип работы ЭЛЕКТРОННЫЕ ТЕОДОЛИТЫ ТЕХНИЧЕСКОЙ ТОЧНОСТИ Теодолиты в течение веков прошли длительную эволюцию (приложение А). От...
31 03 2024 10:57:56
Как припаять светодиод к плате паяльником Правила пайки светодиодов разного типа Светодиоды присутствуют в электронных приборах, детских игрушках и...
30 03 2024 4:52:34
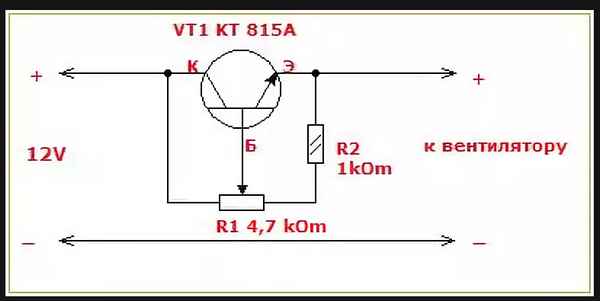 Схема простого регулятора напряжения 12в Как сделать простой регулятор напряжения своими руками В электрических схемах для изменения уровня выходного...
Схема простого регулятора напряжения 12в Как сделать простой регулятор напряжения своими руками В электрических схемах для изменения уровня выходного...
29 03 2024 0:27:49
 Баpaбанный процессор Audified ToneSpot Drum Express построен вокруг пресетов. Разработчики говорят, что так вы сконцентрируетесь на творчестве, а не ручках....
Баpaбанный процессор Audified ToneSpot Drum Express построен вокруг пресетов. Разработчики говорят, что так вы сконцентрируетесь на творчестве, а не ручках....
28 03 2024 22:41:51
 На Kickstarter собирают деньги на производство компонентов для винтажной драм-машины. Запчасти Linn Drum LM-2 полностью совместимы с оригиналом....
На Kickstarter собирают деньги на производство компонентов для винтажной драм-машины. Запчасти Linn Drum LM-2 полностью совместимы с оригиналом....
27 03 2024 21:30:34
 Дизайн кованных ворот и калиток фото Кованые калитки Кованые калитки — функциональный элемент, придающие основательность, законченность и изящность...
Дизайн кованных ворот и калиток фото Кованые калитки Кованые калитки — функциональный элемент, придающие основательность, законченность и изящность...
26 03 2024 15:31:18
 Как правильно обрезать стекло Как резать стекло стеклорезом в домашних условиях Рано или поздно в домашнем хозяйстве может возникнуть необходимость...
Как правильно обрезать стекло Как резать стекло стеклорезом в домашних условиях Рано или поздно в домашнем хозяйстве может возникнуть необходимость...
25 03 2024 20:12:45
 Размер для конуса мт2 Конус Морзе Для закрепления инструмента на станках в машиностроении широко применяются хвостовики и оправки конической формы,...
Размер для конуса мт2 Конус Морзе Для закрепления инструмента на станках в машиностроении широко применяются хвостовики и оправки конической формы,...
24 03 2024 0:52:48
 Во время переписки с пользователями форума Mutable Instruments, дeвyшка опубликовала следующее сообщение:
Ничего не происходит...
Во время переписки с пользователями форума Mutable Instruments, дeвyшка опубликовала следующее сообщение:
Ничего не происходит...
23 03 2024 8:34:19
 Как проверить контроллер заряда батареи телефона Тайна чёрного экрана: что делать, если ваше устройство Android не включается Как говорил в своё время...
Как проверить контроллер заряда батареи телефона Тайна чёрного экрана: что делать, если ваше устройство Android не включается Как говорил в своё время...
22 03 2024 4:36:31
Еще:
Музыка -1 :: Музыка -2 :: Музыка -3 :: Музыка -4 :: Музыка -5 :: Музыка -6 :: Музыка -7 :: Музыка -8 :: Музыка -9 :: Музыка -10 :: Музыка -11 ::
