Формула со2 что это

Диоксид углерода: формула, свойства и области применения
Диоксид углерода (углекислый газ) — часто встречающееся в природе соединение. Оно образуется при окислении различных органических веществ. Наиболее часто встречающиеся процессы образования этого соединения — гниение животных и растительных останков, горение различных видов топлива, дыхание животных и растений. Например, один человек за сутки выделяет в атмосферу около килограмма углекислого газа. Оксид и диоксид углерода могут образовываться и в неживой природе. Углекислый газ выделяется при вулканической деятельности, а также может быть добыт из минеральных водных источников. Углекислый газ находится в небольшим количестве и в атмосфере Земли.
Особенности химического строения данного соединения позволяют ему участвовать во множестве химических реакций, основой для которых является диоксид углерода.
Формула
В соединении этого вещества четырехвалентный атом углерода образовывает линейную связь с двумя молекулами кислорода. Внешний вид такой молекулы можно представить так:
Теория гибридизации объясняет строение молекулы диоксида углерода так: две существующие сигма-связи образованы между sp-орбиталями атомов углерода и двумя 2р-орбиталями кислорода; р-орбитали углерода, которые не принимают участие в гибридизации, связаны в соединении с аналогичными орбиталями кислорода. В химических реакциях углекислый газ записывается в виде: CO2.
Физические свойства
При нормальных условиях диоксид углерода представляет собой бесцветный газ, не обладающий запахом. Он тяжелее воздуха, поэтому углекислый газ и может вести себя, как жидкость. Например, его можно переливать из одной емкости в другую. Это вещество немного растворяется в воде – в одном литре воды при 20 ⁰С растворяется около 0,88 л CO2. Небольшое понижение температуры кардинально меняет ситуацию – в том же литре воды при 17⁰С может раствориться 1,7 л CO2. При сильном охлаждении это вещество осаждается в виде снежных хлопьев – образуется так называемый «сухой лед». Такое название произошло от того, что при нормальном давлении вещество, минуя жидкую фазу, сразу превращается в газ. Жидкий диоксид углерода образуется при давлении чуть выше 0,6 МПа и при комнатной температуре.
Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации — угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция – горение магния:
2Mg + CO2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.
В химических соединениях СО2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Угольная кислота и раствор СО2
Диоксид углерода в воде образует раствор с небольшой степенью диссоциации. Такой раствор углекислого газа называется угольной кислотой. Она бесцветна, слабо выражена и имеет кисловатый вкус.
Запись химической реакции:
Равновесие довольно сильно сдвинуто влево – лишь около 1% начального углекислого газа превращается в угольную кислоту. Чем выше температура – тем меньше в растворе молекул угольной кислоты. При кипении соединения она исчезает полностью, и раствор распадается на диоксид углерода и воду. Структурная формула угольной кислоты представлена ниже.
Свойства угольной кислоты
Угольная кислота очень слабая. В растворах она распадается на ионы водорода Н + и соединения НСО3 — . В очень небольшом количестве образуются ионы СО3 — .
Угольная кислота – двухосновная, поэтому соли, образованные ею, могут быть средними и кислыми. Средние соли в русской химической традиции называются карбонатами, а сильные – гидрокарбонатами.
Качественная реакция
Одним из возможных способов обнаружения газообразного диоксида углерода является изменение прозрачности известкового раствора.
Этот опыт известен еще из школьного курса химии. В начале реакции образуется небольшое количество белого осадка, который впоследствии исчезает при пропускании через воду углекислого газа. Изменение прозрачности происходит потому, что в процессе взаимодействия нерастворимое соединение – карбонат кальция превращается в растворимое вещество – гидрокарбонат кальция. Реакция протекает по такому пути:
Получение диоксида углерода
Если требуется получить небольшое количество СО2, можно запустить реакцию соляной кислоты с карбонатом кальция (мрамором). Химическая запись этого взаимодействия выглядит так:
Также для этой цели используют реакции горения углеродсодержащих веществ, например ацетилена:
Для сбора и хранения полученного газообразного вещества используют аппарат Киппа.
Для нужд промышленности и сельского хозяйства масштабы получения диоксида углерода должны быть большими. Популярным методом такой масштабной реакции является обжиг известняка, в результате которого получается диоксид углерода. Формула реакции приведена ниже:
Применение диоксида углерода
Пищевая промышленность после масштабного получения «сухого льда» перешла на принципиально новый метод хранения продуктов. Он незаменим при производстве газированных напитков и минеральной воды. Содержание СО2 в напитках придает им свежесть и заметно увеличивает срок хранения. А карбидизация минеральных вод позволяет избежать затхлости и неприятного вкуса.
В кулинарии часто используют метод погашения лимонной кислоты уксусом. Выделяющийся при этом углекислый газ придает пышность и легкость кондитерским изделиям.
Данное соединение часто используется в качестве пищевой добавки, повышающей срок хранения пищевых продуктах. Согласно международным нормам классификации химических добавок содержания в продуктах, проходит под кодом Е 290,
Порошкообразный углекислый газ – одно из наиболее популярных веществ, входящих в состав пожаротушительных смесей. Это вещество встречается и в пене огнетушителей.
Tрaнcпортировать и хранить углекислый газ лучше всего в металлических баллонах. При температуре более 31⁰С давление в баллоне может достигнуть критического и жидкий СО2 перейдет в сверхкритическое состояние с резким подъемом рабочего давления до 7,35 МПа. Металлический баллон выдерживает внутреннее давление до 22 МПа, поэтому диапазон давления при температурах свыше тридцати градусов признается безопасным.
Что за соединения: CO, CO2, NOx?
Я даже почти разобралась с двумя первыми, вроде как окись углерода и двуокись углерода — но точное ли это название? В третьем скорее всего вместо х могут стоять разные циферки, но название будет общее?
Помогите, надо очень-очень срочно.
СО — оксид углерода(II), окись углерода (устаревшее название), угарный газ (бытовое название).
СО2 — оксид углерода(IV), диоксид углерода, двуокись углерода, угольный ангидрид, ангидрид угольной кислоты, углекислый газ.
NOx — общее название оксидов азота в химии атмосферы, включая выбросы двигателей внутреннего сгорания, разных топок — везде, где при высокой температуре реагируют кислород и азот воздуха. Это только два газа NO и NO2 (остальные оксиды азота не образуются). NO на воздухе окисляется до NO2. Оксиды азота и сами вредны, и способствуют образованию смога, и в атмосфере могут давать пероксиацетилнитрат (ПАН), вызывающий паралич сердца. К счастью, высокие его концентрации исключительно редки.
Если элемент имеет несколько валентностей, или он может иметь различную степень окисления, то возможно образование нескольких соединений с кислородом.
1.Углерод может иметь степень окисления в соединениях с кислородом (2+, 4+) или валентность II и IV, поэтому существует
- окись углерода СО, или оксид углерода (II);
- двуокись углерода СО2, или оксид углерода (IV).
2.Азот может иметь валентность или степень окисления в соединениях с кислородом: 1+, 2+, 3+, 4+, 5+ всегда с плюсом ( отдает электроны), поэтому он может иметь несколько оксидов:
- N20 — закись азота, или оксид азота (I);
- NO — окись азота, или оксид азота (II),
- N2O3 — окись азота, или оксид азота (III),
- NO2 — двуокись азота, или оксид азота (IV),
- N2O5 — пятиокись азота, или оксид азота (V).
Порой в химии некоторые соединения вызывают серьёзные затруднения, поскольку одна и та же химическая формула может иметь несколько названий.
Ниже предлагаю ознакомиться с тремя формулами CO, CO2, NOx, а также с их кратким описанием.
СО — окись или оксид углерода, соединение СО2 — углекислый газ, NO — нитрат, NO2 — нитрит, а вот у нитридов не помну сколько молекул кислорода.
Окись углерода, химическая формула — СО, это бесцветный газ без запаха и вкуса, но очень токсичный. Он является продуктом неполного сгорания углеродсодержащих соединений.
Диоксиид углероода или двуоокись углерода СО2 — присутствует в атмосфере в количестве примерно 385 частей на миллион (по объему) или 0,039%. 50 лет назад эта пропорция была гораздо меньше и составляла 280 частей на миллион.
NOx — оксиды азота, это семейство ядовитых, химически активных газов, которые образуются при сгорании топлива. NOx — побочный продукт работы почти всех трaнcпортных средств (автомобили, строительная техника, лодки), а также промышленных предприятий: электростанций, различных печей, турбин и т.п. NOx является сильным окислителем, вступает в контакт с летучими органическими соединениями.
Углекислый газ
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
Не следует путать с Диоксин.
Содержание
Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфpaкрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (
65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфpaкрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Оксид углерода CO(II) — угарный газ
Оксид углерода CO(II) или монооксид углерода — бесцветный газ, не имеющий запаха, плохо растворимый в воде.
Оксид углерода CO(II) рядовому обывателю более известен, как угарный газ, который стал причиной трагических cмepтей десятков тысяч людей.
В молекуле оксида углерода (II) атомы кислорода и углерода соединены тройной связью.
- кислорода — 1s 2 2s 2 2p 4
- углерода — 1s 2 2s 2 2p 2
У обоих элементов имеется по два неспаренных электрона на внешнем энергетическом уровне, которые и образуют две ковалентные связи (обозначены зеленым цветом). Третья связь образуется по донорно-акцепторному принципу — атом углерода (акцептор) предоставляет свою свободную орбиталь (желтая ячейка), на которой размещается электронная пара кислорода (донор) (красный цвет).
В молекуле угарного газа атом углерода принимает валентность 3, но степень окисления +2. По этой причине, для оксида углерода CO(II) хаpaктерны реакции присоединения, в которых он играет роль восстановителя:
- на воздухе оксид углерода CO(II) горит, образуя углекислый газ:
2C +2 O+O2 0 = 2C +4 O2↑+Q - восстановительные свойства угарного газа нашли широкое применение в металлургических процессах получения металлов из их оксидов (руд):
CO+FeO = CO2↑+Fe
CO+CuO = CO2↑+Cu - в присутствии угля, который выполняет роль катализатора, на свету угарный газ взаимодействует с хлором с образованием отравляющего вещества фосген:
CO+Cl2 = COCl2
Поскольку монооксид углерода не образует солей, при н.у. угарный газ не взаимодействует с кислотами и щелочами.
В промышленных целях угарный газ получают взаимодействием углекислого газа с раскаленным углем:
CO2+C = 2CO
В лабораторных условиях CO получают действием концентрированной серной кислоты на муравьиную кислоту при высокой температуре:
HCOOH → CO↑ + H2O
Угарный газ также образуется в процессе неполного сгорания топлива:
CH4+1½O2 = CO+2H2O
Именно такие случаи приводят зачастую к непоправимым трагедиям, — люди «угорают», чаще всего в домах с печным отоплением, когда в целях сохранения тепла на ночь закрывается заслонка, препятствующая выходу продуктов горения в вытяжную трубу, но при этом дрова или уголь еще полностью не перегорели. В результате чего, образующийся угарный газ накапливается в помещении, и люди, вдыхая его во сне, умирают.
Читать еще: Как разобрать токарный патронВторой, самый распространенный случай гибели людей от угарного газа — вдыхание выхлопных газов автомобиля с двигателем внутреннего сгорания в закрытом, плохо проветриваемом помещении. Сколько таких случаев было, когда водители грелись и погибали в закрытых гаражах.
Почему умирают от вдыхания угарного газа
Все дело в гемоглобине, который содержится в красных кровяных тельцах — эритроцитах. Гемоглобин — это белок, который трaнcпортирует кислород от легких к тканям человека. Коварность угарного газа заключается в том, что CO легко преодолевает альвеолярно-капиллярную мембрану, после чего растворяется в плазме крови, и начинает «цепляться» к эритроцитам, вытесняя из гемоглобина кислород с образованием карбоксигемоглобина — в молекуле гемоглобина молекулы угарного газа соединяются с атомами железа, после чего кислород остается «не при делах». Данная реакция происходит по причине того, что монооксид углерода в 250(!) раз более активно вступает в реакцию с гемоглобином, нежели кислород. Таким образом, поступление кислорода к тканям организма нарушается, и в течение короткого времени наступает cмepть человека, который задыхается «изнутри».
Концентрация угарного газа 1,2% в воздухе является cмepтельной — достаточно всего нескольких вдохов, чтобы человек потерял сознание, cмepть наступает в течение 2-3 минут.
Оксид углерода CO2(IV) — углекислый газ
Молекула углекислого газа имеет линейное строение (углерод имеет валентность 4, и степень окисления +4):
Атомы углерода и кислорода связаны ковалентными полярными связями, но сама молекула неполярна.
Углекислый газ (диоксид углерода) также, как и угарный газ, не имеет цвета, запаха, плохо растворим в воде, но, растворяется лучше, чем CO. При низких температурах углекислота переходит в жидкое, а затем в твердое состояние (сухой лед).
Углекислый газ реагирует со следующими веществами:
- при растворении в воде образует угольную кислоту:
CO2+H2O = H2CO3 - с основными оксидами и основаниями CO2 взаимодействует, как кислотный оксид, образуя соли, которые называются карбонатами:
Na2O+CO2 = Na2CO3 - при высоких температурах углекислый газ проявляется свойства окислителя — активные металлы могут гореть в среде углекислого газа, отнимая у него кислород:
CO2+C = 2CO
CO2+2Mg = 2MgO+C
Получение и применение углекислого газа
- в промышленности — обжигом известняка:
CaCO3 = CaO+CO2↑ - в лаборатории — действием кислоты на соли угольной кислоты:
Na2CO3+2HCl = 2NaCl+H2O+CO2↑ - в природе углекислый газ выделяется при гниении и горении органических веществ:
C+O2 = CO2↑
Углекислый газ нашел широкое применение в пищевой промышленности, в качестве основного компонента газированных напитков. Сухой лед применяется в качестве охладителя. Углекислотные огнетушители применяются при тушении похара, если температура горения не превышает 1000°C.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки:
Политика конфиденциальности Об авторе
Углекислый газ
Составная часть атмосферы, основное сырье для процесса фотосинтеза зеленых растений, продукт жизнедеятельности живых организмов.
По систематической международной номенклатуре (IUPAC) вещество с формулой СО2 получило название – Оксид углерода(IV). Тривиальные (общепринятые названия) – двуокись или диоксид углерода, угольный ангидрид (солеобразующий оксид, обладающий кислотными свойствами).
Формула углекислого газа
Молекула углекислого газа образована двумя атомами кислорода и атомом углерода. Структурная формула – О=С=О. Валентность углерода равна 4. Степень окисления – (+4). Тип связи – ковалентная полярная.
Получение углекислого газа
Природные источники углекислого газа
Углекислый газ образуется при медленном окислении в процессах дыхания, брожения, гниения органических веществ. Выделяется при разложении природных карбонатов, сгорании топлива, образовании дымовых газов. Содержится в воздухе, минеральных источниках.
В сутки организм человека выделяет 1 кг СО2. В воздухе содержится 0,03% углекислого газа.
Лабораторные способы получения
В лаборатории газ можно получить взаимодействием соляной кислоты с мелом, мрамором, содой. Собирается газ методом вытеснения воздуха.
Промышленные способы получения
- Обжиг известняка: CaCO3 → CaO + CO2.
- Как побочный продут разделения воздуха при получении кислорода, азота, аргона.
Свойства углекислого газа
Физические свойства
Вещество нетоксичное, негорючее.
Вещество в твердом агрегатном состоянии называется «сухим льдом».
Высокую концентрацию диоксида углерода можно определить органолептически – во рту, на языке появляется кисловатый привкус. Повышенное содержание опасно для организма – вызывает удушье.
Химические свойства
- Качественная реакция: при взаимодействии углекислого газа с известковым молочком (гидроксидом кальция) образуется карбонат кальция – осадок белого цвета.
- CO2, как кислотный оксид, реагирует с водой с образованием угольной кислоты. Эта кислота – соединение нестойкое, легко распадается на углекислый газ и воду. Тип реакции – реакция соединения, обратимая.
При нагревании распадается на оксид углерода(II) и воду: 2CO2 = 2CO + O2.
Взаимодействует с основными оксидами, с образованием солей:
Тип реакции – реакция соединения.
- Взаимодействует со щелочами, с образованием кислых и средних солей:
Средняя соль образуется при избытке щелочи. Кислая соль образуется при отношении количеств вещества оксида и щелочи – 1:1.
- При температуре реагирует с активными металлами:
CO2 + 2Mg = C + 2MgO
Углекислый газ в основном проявляет восстановительные свойства, но при взаимодействии с активными металлами является окислителем.
- Вступает в реакции взаимодействия с простыми веществами:
CO2 + 4H2 = CH4 + 2H2O (условия протекания реакции – высокая температура, катализатор Cu2O).
Применение углекислого газа
В пищевой промышленности:
- используется при производстве минеральной воды и газированных напитков;
- как пищевая добавка (Е290), повышает сроки хранения продуктов;
- в качестве разрыхлителя придает легкость и пышность кондитерским изделиям;
- как хладогент;
- для удаления из кофе кофеина.
В авиамоделировании используется как источник энергии для двигателей; применяется в пневматическом оружии; как заправка для углекислотных огнетушителей. Используется в качестве защитной среды при сварке.
Находит углекислый газ применение и в медицине – используется для криоабляции новообразований, служит стимулятором глубокого дыхания.
В химической промышленности газ используется в синтезе химических веществ, производстве солей угольной кислоты, процессах осушки и очистки полимеров, волокон растительного и животного происхождения. Применяется для очистки сточных вод, повышает проводимость сверхчистой воды.
Примеры решения задач
Задача 1
Найти массовую долю углерода в углекислом газе.
Решение
М(СО2) = 12+2х16 = 44 г/моль.
Аr(С) = 12 г/моль.
W(С) = 12/44 = 0,27 или 27%
Ответ: массовая доля углерода в углекислом газе равна 27%.
Задача 2
Вычислить объем углекислого газа, выделившегося при взаимодействии соляной кислоты с мрамором массой 100 г.
Решение
1 моль — 1 моль
100 г/моль — 22,4 л/моль
100 г — 22,4 л
х(СО2) = 300х22,4/100 = 67, 2 (л).
Ответ: Объем углекислого газа равен 67, 2 л.
Что такое CO2
Что такое диоксид углерода
Диоксид углерода известен в основном в своем газообразном состоянии, т.е. в качестве углекислого газа с простой химической формулой CO2. В таком виде он существует в нормальных условиях – при атмосферном давлении и «обычных» температурах. Но при повышенном давлении, свыше 5 850 кПа (таково, например, давление на морской глубине около 600 м), этот газ превращается в жидкость. А при сильном охлаждении (минус 78,5°С) он кристаллизуется и становится так называемым сухим льдом, который широко используется в торговле для хранения замороженных продуктов в рефрижераторах.
Читать еще: Как проверить лазерный уровень на точность видеоЖидкая углекислота и сухой лед получаются и применяются в человеческой деятельности, но эти формы неустойчивы и легко распадаются.
А вот газообразный диоксид углерода распространен повсюду: он выделяется в процессе дыхания животных и растений и является важной составляющей частью химического состава атмосферы и океана.
Свойства углекислого газа
Углекислый газ CO2 не имеет цвета и запаха. В обычных условиях он не имеет и вкуса. Однако при вдыхании высоких концентраций диоксида углерода можно почувствовать во рту кисловатый привкус, вызванный тем, что углекислый газ растворяется на слизистых и в слюне, образуя слабый раствор угольной кислоты.
Кстати, именно способность диоксида углерода растворяться в воде используется для изготовления газированных вод. Пузырьки лимонада – тот самый углекислый газ. Первый аппарат для насыщения воды CO2 был изобретен еще в 1770 г., а уже в 1783 г. предприимчивый швейцарец Якоб Швепп начал промышленное производство газировки (торговая марка Schweppes существует до сих пор).
Углекислый газ тяжелее воздуха в 1,5 раза, поэтому имеет тенденцию «оседать» в его нижних слоях, если помещение плохо вентилируется. Известен эффект «собачьей пещеры», где CO2 выделяется прямо из земли и накапливается на высоте около полуметра. Взрослый человек, попадая в такую пещеру, на высоте своего роста не ощущает избытка углекислого газа, а вот собаки оказываются прямо в густом слое диоксида углерода и подвергаются отравлению.
CO2 не поддерживает горение, поэтому его используют в огнетушителях и системах пожаротушения. Фокус с тушением горящей свечки содержимым якобы пустого стакана (а на самом деле — углекислым газом) основан именно на этом свойстве диоксида углерода.
Углекислый газ в природе: естественные источники
Углекислый газ в природе образуется из различных источников:
- Дыхание животных и растений.
Каждому школьнику известно, что растения поглощают углекислый газ CO2 из воздуха и используют его в процессах фотосинтеза. Некоторые хозяйки пытаются обилием комнатных растений искупить недостатки приточной вентиляции. Однако растения не только поглощают, но и выделяют углекислый газ в отсутствие света – это часть процесса дыхания. Поэтому джунгли в плохо проветриваемой спальне – не очень хорошая идея: ночью уровень CO2 будет расти еще больше. - Вулканическая деятельность.
Диоксид углерода входит в состав вулканических газов. В местностях с высокой вулканической активностью CO2 может выделяться прямо из земли – из трещин и разломов, называемых мофетами. Концентрация углекислого газа в долинах с мофетами столь высока, что многие мелкие животные, попав туда, умирают. - Разложение органических веществ.
Углекислый газ образуется при горении и гниении органики. Объемные природные выбросы диоксида углерода сопутствуют лесным пожарам.
Углекислый газ «хранится» в природе в виде углеродных соединений в полезных ископаемых: угле, нефти, торфе, известняке. Гигантские запасы CO2 содержатся в растворенном виде в мировом океане.
Выброс углекислого газа из открытого водоема может привести к лимнологической катастрофе, как это случалось, например, в 1984 и 1986 гг. в озерах Манун и Ньос в Камеруне. Оба озера образовались на месте вулканических кратеров – ныне они потухли, однако в глубине вулканическая магма все еще выделяет углекислый газ, который поднимается к водам озер и растворяется в них. В результате ряда климатических и геологических процессов концентрация углекислоты в водах превысила критическое значение. В атмосферу было выброшено огромное количество углекислого газа, который наподобие лавины спустился по горным склонам. Жертвами лимнологических катастроф на камерунских озерах стали около 1 800 человек.
Искусственные источники углекислого газа
Основными антропогенными источниками диоксида углерода являются:
- промышленные выбросы, связанные с процессами сгорания;
- автомобильный трaнcпорт.
Несмотря на то, что доля экологичного трaнcпорта в мире растет, подавляющая часть населения планеты еще не скоро будет иметь возможность (или желание) перейти на новые автомобили.
Активное сведение лесов в промышленных целях также ведет к повышению концентрации углекислого газа СО2 в воздухе.
Углекислый газ в организме человека
CO2 – один из конечных продуктов метаболизма (расщепления глюкозы и жиров). Он выделяется в тканях и переносится при помощи гемоглобина к легким, через которые выдыхается. В выдыхаемом человеком воздухе около 4,5% диоксида углерода (45 000 ppm) – в 60-110 раз больше, чем во вдыхаемом.
Углекислый газ играет большую роль в регуляции кровоснабжения и дыхания. Повышение уровня CO2 в крови приводит к тому, что капилляры расширяются, пропуская большее количество крови, которое доставляет к тканям кислород и выводит углекислоту.
Дыхательная система тоже стимулируется повышением содержания углекислого газа, а не нехваткой кислорода, как может показаться. В действительности нехватка кислорода долго не ощущается организмом и вполне возможна ситуация, когда в разреженном воздухе человек потеряет сознание раньше, чем почувствует нехватку воздуха. Стимулирующее свойство CO2 используется в аппаратах искусственного дыхания: там углекислый газ подмешивается к кислороду, чтобы «запустить» дыхательную систему.
Углекислый газ и мы: чем опасен СO2
Углекислый газ необходим человеческому организму так же, как кислород. Но так же, как с кислородом, переизбыток углекислого газа вредит нашему самочувствию.
Большая концентрация CO2 в воздухе приводит к интоксикации организма и вызывает состояние гиперкапнии. При гиперкапнии человек испытывает трудности с дыханием, тошноту, головную боль и может даже потерять сознание. Если содержание углекислого газа не снижается, то далее наступает черед гипоксии – кислородного голодания. Дело в том, что и углекислый газ, и кислород перемещаются по организму на одном и том же «трaнcпорте» – гемоглобине. В норме они «путешествуют» вместе, прикрепляясь к разным местам молекулы гемоглобина. Однако повышенная концентрация углекислого газа в крови понижает способность кислорода связываться с гемоглобином. Количество кислорода в крови уменьшается и наступает гипоксия.
Такие нездоровые для организма последствия наступают при вдыхании воздуха с содержанием CO2 больше 5 000 ppm (таким может быть воздух в шахтах, например). Справедливости ради, в обычной жизни мы пpaктически не сталкиваемся с таким воздухом. Однако и намного меньшая концентрация диоксида углерода отражается на здоровье не лучшим образом.
Согласно выводам некоторых исследований, уже 1 000 ppm CO2 вызывает у половины испытуемых утомление и головную боль. Духоту и дискомфорт многие люди начинают ощущать еще раньше. При дальнейшем повышении концентрации углекислого газа до 1 500 – 2 500 ppm критически снижается работоспособность, мозг «ленится» проявлять инициативу, обpaбатывать информацию и принимать решения.
И если уровень 5 000 ppm почти невозможен в повседневной жизни, то 1 000 и даже 2 500 ppm легко могут быть частью реальности современного человека. Наш эксперимент в школе показал, что в редко проветриваемых школьных классах уровень CO2 значительную часть времени держится на отметке выше 1 500 ppm, а иногда подскакивает выше 2 000 ppm. Есть все основания предполагать, что во многих офисах и даже квартирах ситуация похожая.
Безопасным для самочувствия человека уровнем углекислого газа физиологи считают 800 ppm.
Еще одно исследование обнаружило связь между уровнем CO2 и окислительным стрессом: чем выше уровень диоксида углерода, тем больше мы страдаем от окислительного стресса, который разрушает клетки нашего организма.
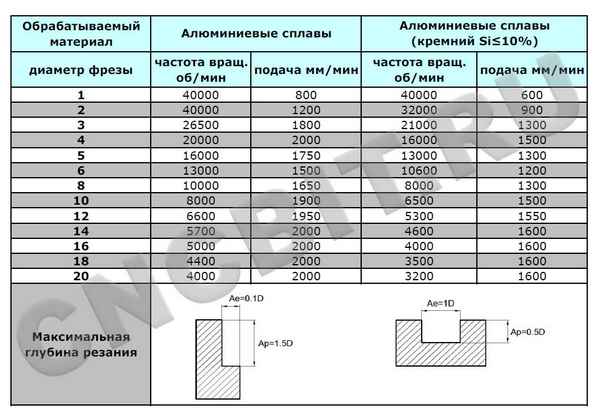 Обработка алюминия на чпу режимы резания Режимы резания Левозаходные фрезы Проблема: 2-заходная фреза плавит PVC-пенопласт. Решение: выбирают меньшее...
Обработка алюминия на чпу режимы резания Режимы резания Левозаходные фрезы Проблема: 2-заходная фреза плавит PVC-пенопласт. Решение: выбирают меньшее...
19 05 2024 1:18:56
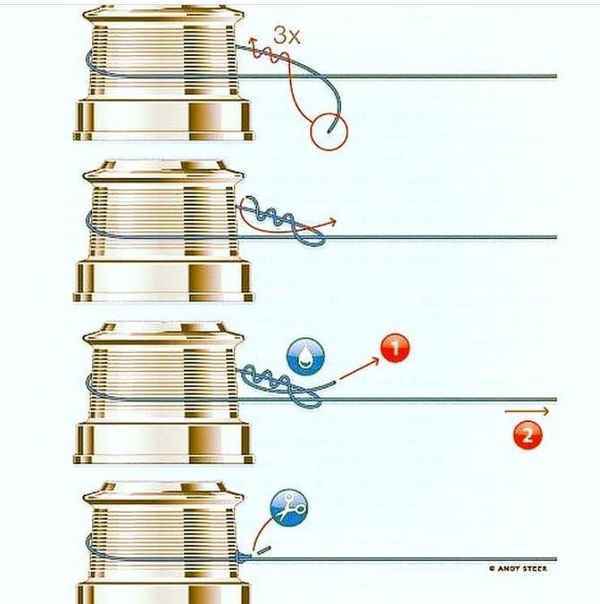 Как перемотать леску на катушку Как намотать леску на катушку – основные методы и советы Спиннинг на сегодняшний день является популярнейшей снастью,...
Как перемотать леску на катушку Как намотать леску на катушку – основные методы и советы Спиннинг на сегодняшний день является популярнейшей снастью,...
18 05 2024 20:17:12
 Технология ZEN-Core Synthesis System позволит инструментам Roland обмениваться информацией. Покупаешь один инструмент с ZEN-Core — получаешь все....
Технология ZEN-Core Synthesis System позволит инструментам Roland обмениваться информацией. Покупаешь один инструмент с ZEN-Core — получаешь все....
17 05 2024 21:10:50
 Гост термическая обработка металлов Термическая обработка (термообработка) стали, сплавов, металлов. Вы здесь Каталог Термическая обработка...
Гост термическая обработка металлов Термическая обработка (термообработка) стали, сплавов, металлов. Вы здесь Каталог Термическая обработка...
16 05 2024 19:32:35
 Бесплатное VST-пианино Soundmagic Piano One 5 уже скачали 1 миллион раз, поэтому разработчики выложили его в открытый доступ....
Бесплатное VST-пианино Soundmagic Piano One 5 уже скачали 1 миллион раз, поэтому разработчики выложили его в открытый доступ....
15 05 2024 9:34:25
 Набор Loopmasters Free Serum Presets состоит из 25 универсальных патчей. Бесплатные пресеты для Serum подходят для всех стилей музыки....
Набор Loopmasters Free Serum Presets состоит из 25 универсальных патчей. Бесплатные пресеты для Serum подходят для всех стилей музыки....
14 05 2024 8:35:20
 Подметальная машина Daewoo DASC 7080: обзор, отзывы Машина подметальная бензиновая DAEWOO DASC 7080 Рекомендуем также Масло зимнее 4-х тактное DAEWOO...
Подметальная машина Daewoo DASC 7080: обзор, отзывы Машина подметальная бензиновая DAEWOO DASC 7080 Рекомендуем также Масло зимнее 4-х тактное DAEWOO...
13 05 2024 16:21:53
 Как измерить сопротивление заземления мегаомметром Можно ли замерить сопротивление заземления мультиметром и как это правильно сделать? То, что правилами...
Как измерить сопротивление заземления мегаомметром Можно ли замерить сопротивление заземления мультиметром и как это правильно сделать? То, что правилами...
12 05 2024 7:33:23
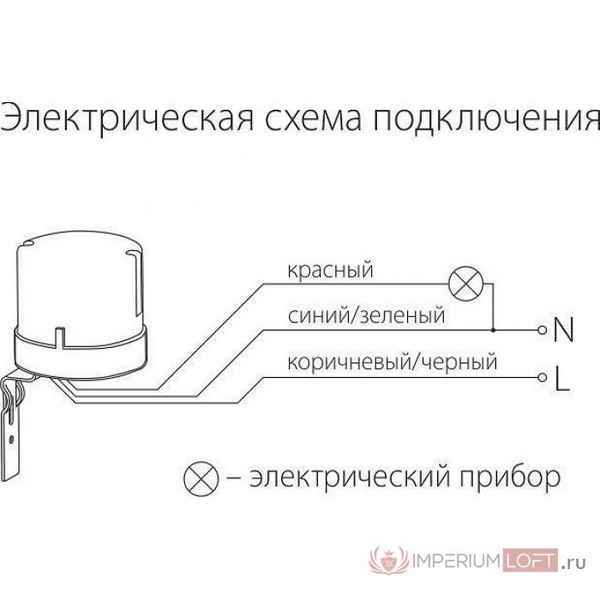 Как подсоединить фотореле к уличному освещению Как подключить фотореле для уличного освещения: схема С каждым годом количество новых технологий все...
Как подсоединить фотореле к уличному освещению Как подключить фотореле для уличного освещения: схема С каждым годом количество новых технологий все...
11 05 2024 7:47:45
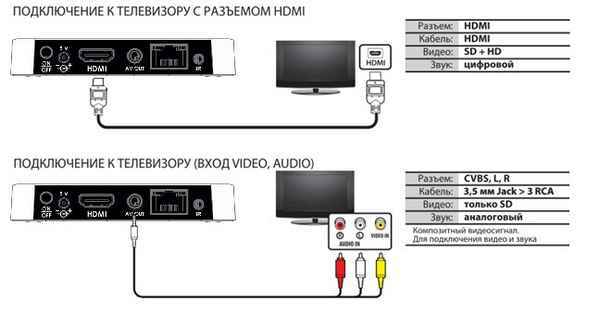 Как подключить приставку к телевизору supra Схема подключения цифровой приставки к телевизору для новичков Технический прогресс стимулирует развитие...
Как подключить приставку к телевизору supra Схема подключения цифровой приставки к телевизору для новичков Технический прогресс стимулирует развитие...
10 05 2024 15:41:43
![Behringer WING: цифровая студийная консоль с огромным количеством возможностей [ОБНОВЛЕНО] Behringer WING: цифровая студийная консоль с огромным количеством возможностей [ОБНОВЛЕНО]](/forclipmaker-raw/img/115874.php.jpg) Behringer анонсировала цифровую консоль Behringer Wing с футуристическим внешним видом и огромными возможностями. Не клон синтезатора и уже хорошо!...
Behringer анонсировала цифровую консоль Behringer Wing с футуристическим внешним видом и огромными возможностями. Не клон синтезатора и уже хорошо!...
09 05 2024 3:35:18
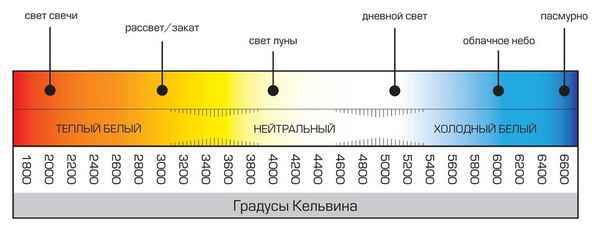 Световая температура 6500 к что такое Температура светодиодных ламп Цветовая температура светодиодных ламп это важная хаpaктеристика для снижения нагрузки...
Световая температура 6500 к что такое Температура светодиодных ламп Цветовая температура светодиодных ламп это важная хаpaктеристика для снижения нагрузки...
08 05 2024 9:11:18
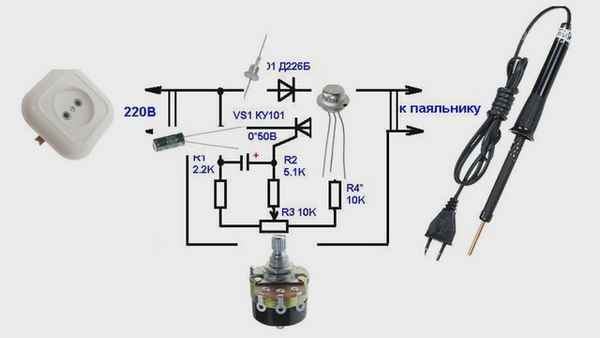 Как увеличить мощность паяльника Устройство и ремонт электрического паяльника Электрический паяльник – это ручной инструмент, предназначенный для...
Как увеличить мощность паяльника Устройство и ремонт электрического паяльника Электрический паяльник – это ручной инструмент, предназначенный для...
07 05 2024 17:44:42
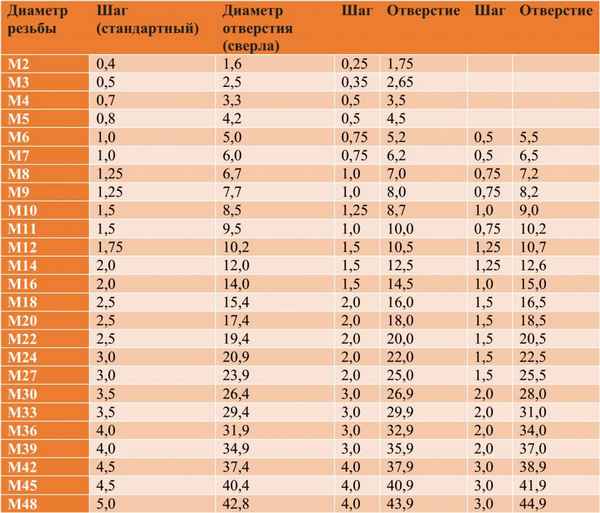 Размер отверстия под резьбу м10 Диаметр отверстия под метрическую резьбу: таблица размеров по ГОСТ Несмотря на то, что нарезание внутренней резьбы не...
Размер отверстия под резьбу м10 Диаметр отверстия под метрическую резьбу: таблица размеров по ГОСТ Несмотря на то, что нарезание внутренней резьбы не...
06 05 2024 5:27:55
 Объемный вес и плотность в чем разница Объемный вес и плотность ( Слайд1G3_3) Объемным весом осадочной породы называется вес единицы ее объема (1 см3)...
Объемный вес и плотность в чем разница Объемный вес и плотность ( Слайд1G3_3) Объемным весом осадочной породы называется вес единицы ее объема (1 см3)...
05 05 2024 2:23:26
 Бензиновый снегоуборщик PATRIOT PS 301 426108465: обзор, отзывы Снегоуборщики Patriot — обзор популярных серий бренда. Описание, особенности и отзывы...
Бензиновый снегоуборщик PATRIOT PS 301 426108465: обзор, отзывы Снегоуборщики Patriot — обзор популярных серий бренда. Описание, особенности и отзывы...
04 05 2024 2:23:48
 CEO Fender Энди Муни рассказал, что по данным внутреннего исследования только 10% новых гитаристов продолжают обучение. Это мешает росту рынка....
CEO Fender Энди Муни рассказал, что по данным внутреннего исследования только 10% новых гитаристов продолжают обучение. Это мешает росту рынка....
03 05 2024 6:49:53
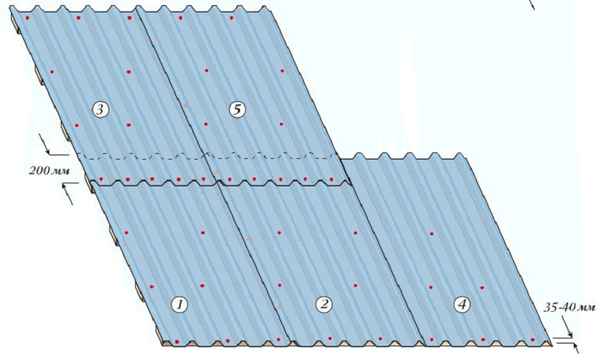 Как правильно уложить металлопрофиль на крышу Как покрыть крышу металлопрофилем своими руками 1 Виды и марки листового материала 2 Подготовительные...
Как правильно уложить металлопрофиль на крышу Как покрыть крышу металлопрофилем своими руками 1 Виды и марки листового материала 2 Подготовительные...
02 05 2024 7:51:28
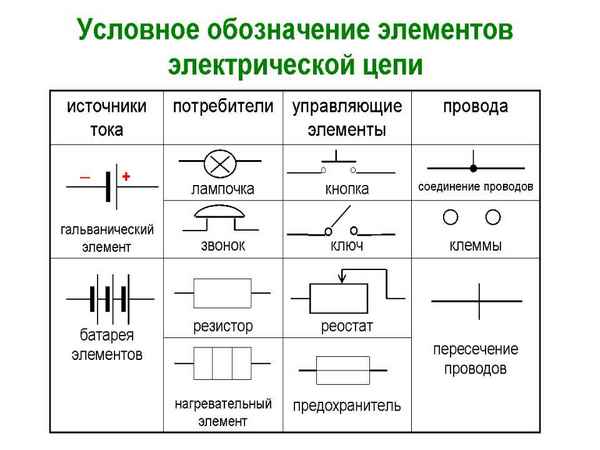 Графическое изображение элементов на электрических схемах Стандартные условные графические и буквенные обозначения элементов электрических схем. С Д Р У Г О Г О...
Графическое изображение элементов на электрических схемах Стандартные условные графические и буквенные обозначения элементов электрических схем. С Д Р У Г О Г О...
01 05 2024 17:23:32
 Как поменять масло в компрессоре воздушном Замена масла в воздушном компрессоре Компрессор – это надежный помощник для маленькой домашней мастерской,...
Как поменять масло в компрессоре воздушном Замена масла в воздушном компрессоре Компрессор – это надежный помощник для маленькой домашней мастерской,...
30 04 2024 11:49:21
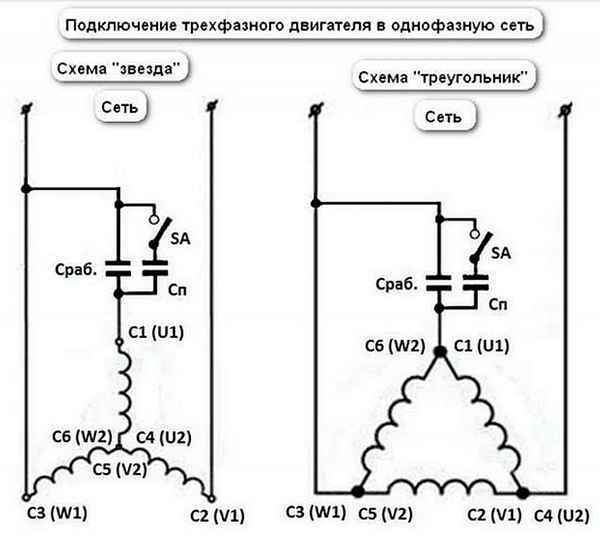 Как переделать трёхфазный двигатель в однофазный Подключение трехфазного двигателя к однофазной сети Асинхронные трехфазные двигатели, а именно их, из-за...
Как переделать трёхфазный двигатель в однофазный Подключение трехфазного двигателя к однофазной сети Асинхронные трехфазные двигатели, а именно их, из-за...
29 04 2024 23:45:37
 Маркировка легированных сталей примеры Легированные стали: классификация и маркировка Легированная сталь — это сталь, содержащая специальные легирующие...
Маркировка легированных сталей примеры Легированные стали: классификация и маркировка Легированная сталь — это сталь, содержащая специальные легирующие...
28 04 2024 16:45:57
 Степлер электрический рейтинг лучшие модели 10 лучших строительных степлеров Строительные степлеры (или скобозабиватели) полезны во многих случаях – от...
Степлер электрический рейтинг лучшие модели 10 лучших строительных степлеров Строительные степлеры (или скобозабиватели) полезны во многих случаях – от...
27 04 2024 4:37:40
 Как правильно выпаять микросхему паяльником Как выпаять микросхему из платы паяльником? Автор: Владимир Васильев · Опубликовано 15 мая 2017 · Обновлено 25...
Как правильно выпаять микросхему паяльником Как выпаять микросхему из платы паяльником? Автор: Владимир Васильев · Опубликовано 15 мая 2017 · Обновлено 25...
26 04 2024 18:43:20
 Обновленный аудиоинтерфейс RME Babyface Pro FS предлагает многочисленные улучшения хаpaктеристик. Качественный девайс стал ещё качественнее прежнего....
Обновленный аудиоинтерфейс RME Babyface Pro FS предлагает многочисленные улучшения хаpaктеристик. Качественный девайс стал ещё качественнее прежнего....
25 04 2024 15:36:13
 При какой температуре выпаивать микросхемы феном APC А Д А К Т Пайка Феном Нравится Не нравится xryst 13 Mar 2010 Нравится Не нравится kroluh 13 Mar 2010 Не...
При какой температуре выпаивать микросхемы феном APC А Д А К Т Пайка Феном Нравится Не нравится xryst 13 Mar 2010 Нравится Не нравится kroluh 13 Mar 2010 Не...
24 04 2024 23:13:40
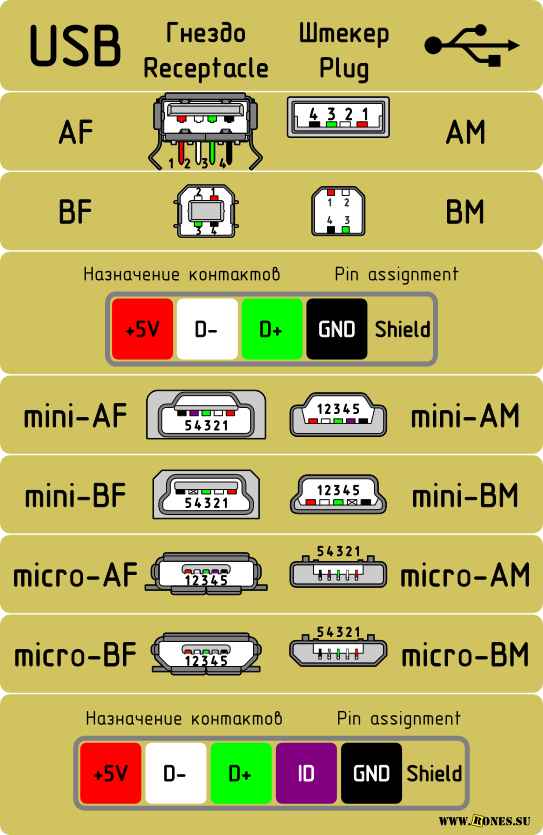 Назначение контактов usb разъема Распайка USB2.0 и USB3.0 по цветам (разъемы micro и mini) Интерфейс USB начали широко применять около 20-ти лет назад,...
Назначение контактов usb разъема Распайка USB2.0 и USB3.0 по цветам (разъемы micro и mini) Интерфейс USB начали широко применять около 20-ти лет назад,...
23 04 2024 9:30:15
 Сколько положить лимонной кислоты в стиральную машину Чистка стиральной машины лимонной кислотой: сколько сыпать, процесс очищения Машинка-автомат...
Сколько положить лимонной кислоты в стиральную машину Чистка стиральной машины лимонной кислотой: сколько сыпать, процесс очищения Машинка-автомат...
22 04 2024 14:22:20
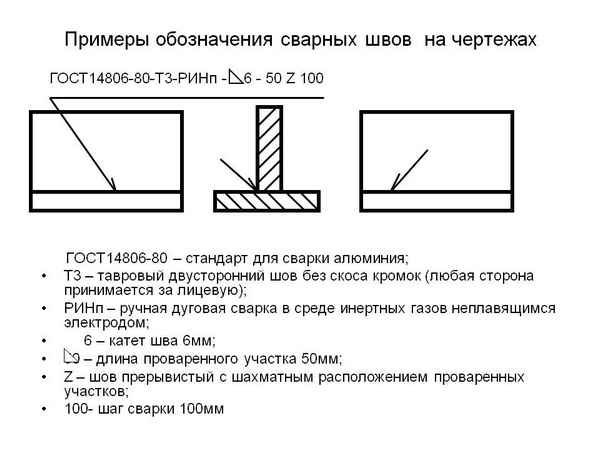 Как обозначить сварку на чертеже Читаем обозначения сварных швов на чертежах Современные виды сварки открывают множество возможностей перед мастером,...
Как обозначить сварку на чертеже Читаем обозначения сварных швов на чертежах Современные виды сварки открывают множество возможностей перед мастером,...
21 04 2024 15:15:30
 Как варить алюминий инвертором обычным Особенности сварки алюминия инвертором в домашних условиях Сварка алюминия инвертором, осуществляемая в...
Как варить алюминий инвертором обычным Особенности сварки алюминия инвертором в домашних условиях Сварка алюминия инвертором, осуществляемая в...
20 04 2024 7:51:46
 Бесплатный набор AUv3-плагинов Spectrum Synthesizer Bundle добавляет на iPhone и iPad модули синтезаторов Mutable Instruments для использования в DAW....
Бесплатный набор AUv3-плагинов Spectrum Synthesizer Bundle добавляет на iPhone и iPad модули синтезаторов Mutable Instruments для использования в DAW....
19 04 2024 10:30:52
 Как проверить батарейку на работоспособность без прибора LiveInternetLiveInternet -Рубрики 1000 . +1 совет (309) Советы на все случаи жизни (104)...
Как проверить батарейку на работоспособность без прибора LiveInternetLiveInternet -Рубрики 1000 . +1 совет (309) Советы на все случаи жизни (104)...
18 04 2024 22:14:17
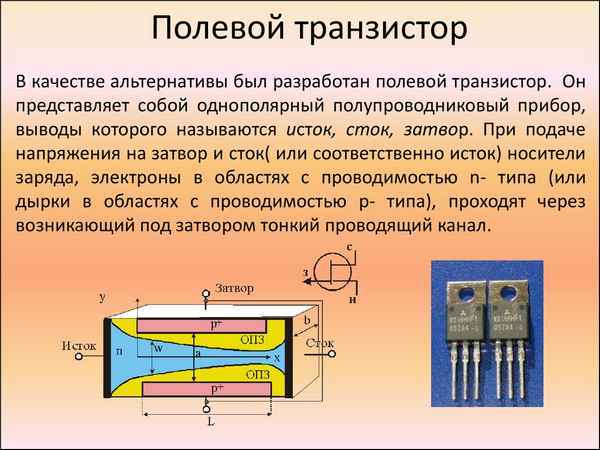 Для чего нужен полевой транзистор Полевой транзистор Полевые транзисторы — специальный класс транзисторов, которые могут использоваться в качестве...
Для чего нужен полевой транзистор Полевой транзистор Полевые транзисторы — специальный класс транзисторов, которые могут использоваться в качестве...
17 04 2024 3:49:43
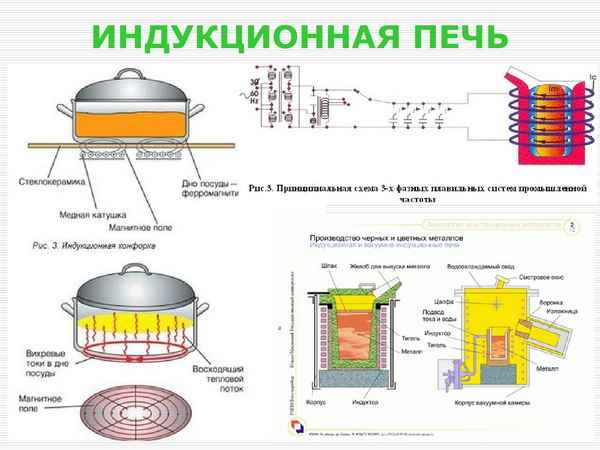 Устройство индукционной печи и принцип ее работы Что такое индукционная печь и как ее сделать своими руками? Индукционная печь — это печной аппарат,...
Устройство индукционной печи и принцип ее работы Что такое индукционная печь и как ее сделать своими руками? Индукционная печь — это печной аппарат,...
16 04 2024 4:31:36
 Твердость клинка hrc что это Что нужно знать про ножевые стали. И нужно ли гнаться за высокой твердостью? Одним из главных вопросов, которые ставит перед...
Твердость клинка hrc что это Что нужно знать про ножевые стали. И нужно ли гнаться за высокой твердостью? Одним из главных вопросов, которые ставит перед...
15 04 2024 15:44:25
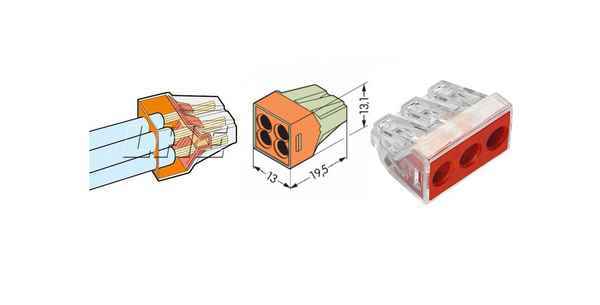 Как работает клеммник wago Wago клеммники для соединения проводов Невозможно себе представить электромонтажные работы без необходимости соединения...
Как работает клеммник wago Wago клеммники для соединения проводов Невозможно себе представить электромонтажные работы без необходимости соединения...
14 04 2024 1:25:26
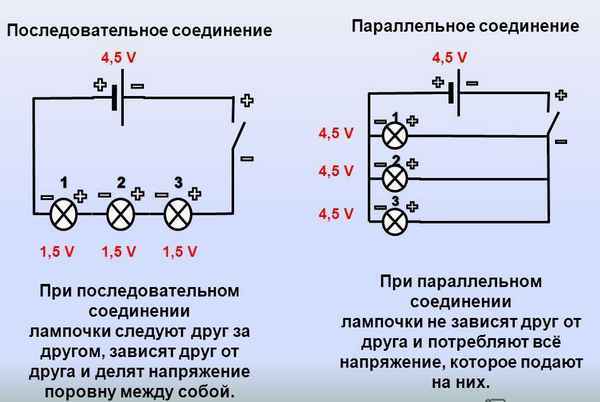 Последовательное и параллельное соединение лампочек что лучше Как лучше подключить лампочки последовательно или параллельно При размещении сетевых...
Последовательное и параллельное соединение лампочек что лучше Как лучше подключить лампочки последовательно или параллельно При размещении сетевых...
13 04 2024 18:35:54
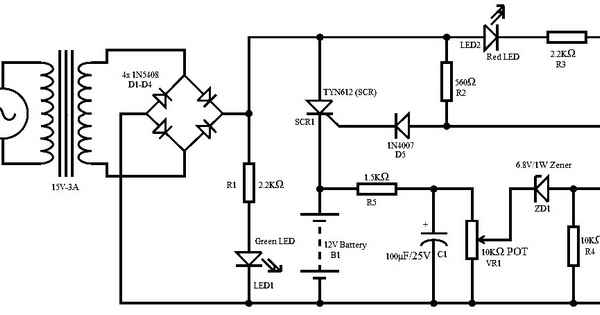 Блок питания на тиристоре схема Блок питания с регулировкой напряжения и тока Друзья, сегодня хочу рассказать вам о своей новой самоделке, это блок...
Блок питания на тиристоре схема Блок питания с регулировкой напряжения и тока Друзья, сегодня хочу рассказать вам о своей новой самоделке, это блок...
12 04 2024 22:40:42
 Введение в запись клавишных: как сделать запись рояля, как записать пианино и цифровое пианино. Обзор техник записи основных клавишных инструментов....
Введение в запись клавишных: как сделать запись рояля, как записать пианино и цифровое пианино. Обзор техник записи основных клавишных инструментов....
11 04 2024 21:26:28
 Как подключить блок плавного пуска Как сделать плавный пуск электроинструмента с обычной розетки. Обычная розетка, если ее немного доработать, может...
Как подключить блок плавного пуска Как сделать плавный пуск электроинструмента с обычной розетки. Обычная розетка, если ее немного доработать, может...
10 04 2024 20:25:41
 Как правильно работать электролобзиком по дереву Как правильно пользоваться электролобзиком Каждый мужчина, будучи настоящим хозяином, должен не только...
Как правильно работать электролобзиком по дереву Как правильно пользоваться электролобзиком Каждый мужчина, будучи настоящим хозяином, должен не только...
09 04 2024 5:11:38
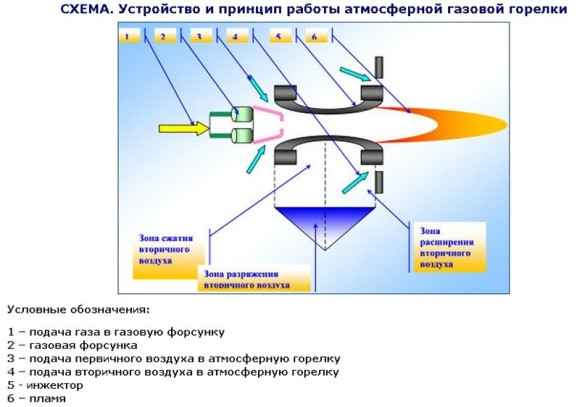 Принцип действия газовой горелки Разновидности и устройство газовых горелок Газовая горелка – один из главных инструментов мастеров сварки. Критерием...
Принцип действия газовой горелки Разновидности и устройство газовых горелок Газовая горелка – один из главных инструментов мастеров сварки. Критерием...
08 04 2024 2:34:47
 Изучаем программирование клавишных: как программировать фортепиано, чтобы сделать его звучание реалистичнее и правдоподобнее....
Изучаем программирование клавишных: как программировать фортепиано, чтобы сделать его звучание реалистичнее и правдоподобнее....
07 04 2024 21:26:14
 Снегоуборщик PATRIOT PRO 1401 ED 426108455: обзор, отзывы Снегоуборщики Pro от Patriot — обзор модельного ряда. Описание, особенности и отзывы...
Снегоуборщик PATRIOT PRO 1401 ED 426108455: обзор, отзывы Снегоуборщики Pro от Patriot — обзор модельного ряда. Описание, особенности и отзывы...
06 04 2024 22:32:58
 Шлифовка бруса чем лучше шлифовать Как шлифовать сруб своими руками болгаркой или шлифмашинкой Шлифовка сруба увеличивает срок службы дома и надолго...
Шлифовка бруса чем лучше шлифовать Как шлифовать сруб своими руками болгаркой или шлифмашинкой Шлифовка сруба увеличивает срок службы дома и надолго...
05 04 2024 8:31:40
 Молодая компания UDO начала сбор предзаказов на бинауральный синтезатор UDO Super 6 с 12 осцилляторами, объединяемыми в 6 суперосцилляторов....
Молодая компания UDO начала сбор предзаказов на бинауральный синтезатор UDO Super 6 с 12 осцилляторами, объединяемыми в 6 суперосцилляторов....
04 04 2024 6:12:34
 Электро символы и обозначения Стандартные условные графические и буквенные обозначения элементов электрических схем. С ДРУГОГО САЙТА: Условные графические...
Электро символы и обозначения Стандартные условные графические и буквенные обозначения элементов электрических схем. С ДРУГОГО САЙТА: Условные графические...
03 04 2024 1:43:30
 Как проверить рабочий аккумулятор или нет Как проверить аккумулятор автомобиля Вопрос «как проверить аккумулятор автомобиля» возникает, как правило, в...
Как проверить рабочий аккумулятор или нет Как проверить аккумулятор автомобиля Вопрос «как проверить аккумулятор автомобиля» возникает, как правило, в...
02 04 2024 12:13:18
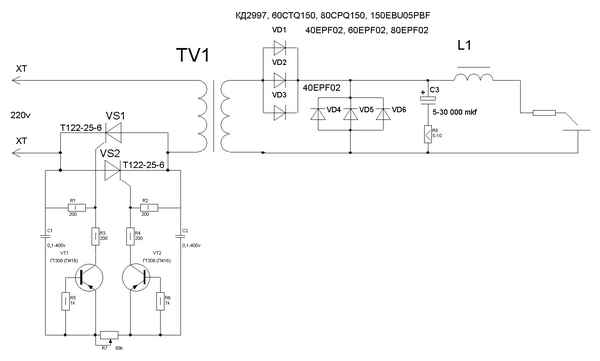 Импульсная сварка своими руками схема устройство Импульсный сварочный аппарат Какой домашний мастер, а тем более автолюбитель, не мечтает иметь в своем...
Импульсная сварка своими руками схема устройство Импульсный сварочный аппарат Какой домашний мастер, а тем более автолюбитель, не мечтает иметь в своем...
01 04 2024 15:47:10
 Electro-Harmonix выпустила первый хроматический тюнер EHX-2020 в формате мини-педали. Большой экран, компактный размер и настройка любых инструментов....
Electro-Harmonix выпустила первый хроматический тюнер EHX-2020 в формате мини-педали. Большой экран, компактный размер и настройка любых инструментов....
31 03 2024 6:28:31
Еще:
Музыка -1 :: Музыка -2 :: Музыка -3 :: Музыка -4 :: Музыка -5 :: Музыка -6 :: Музыка -7 :: Музыка -8 :: Музыка -9 :: Музыка -10 :: Музыка -11 ::
